早期筛选中双特异性抗体的单步蛋白 A 层析工艺的开发
在早期筛选中使用蛋白 A 层析纯化双特异性抗体 (BsAb) 的单步下游工艺已被开发出来,目的是替代现有的三步工艺。目的是从片段(如单个重链和轻链对)中分离 BsAb 单体。选择 MabSelect PrismA 蛋白 A 填料用于捕获步骤。通过 pH 梯度洗脱(pH 值 5 至 3.5),可在捕获步骤中尽早除去大部分片段,无需额外纯化步骤。使用所述单步工艺高效纯化目标 BsAb,实现高回收率和高纯度。
简介
近年来,BsAb 因其广泛的应用而引起了越来越多的关注,例如它是潜在的癌症免疫治疗候选抗体或药物递送载体 (1, 2)。BsAb 有多种类型,但它们都有两个主要特性:
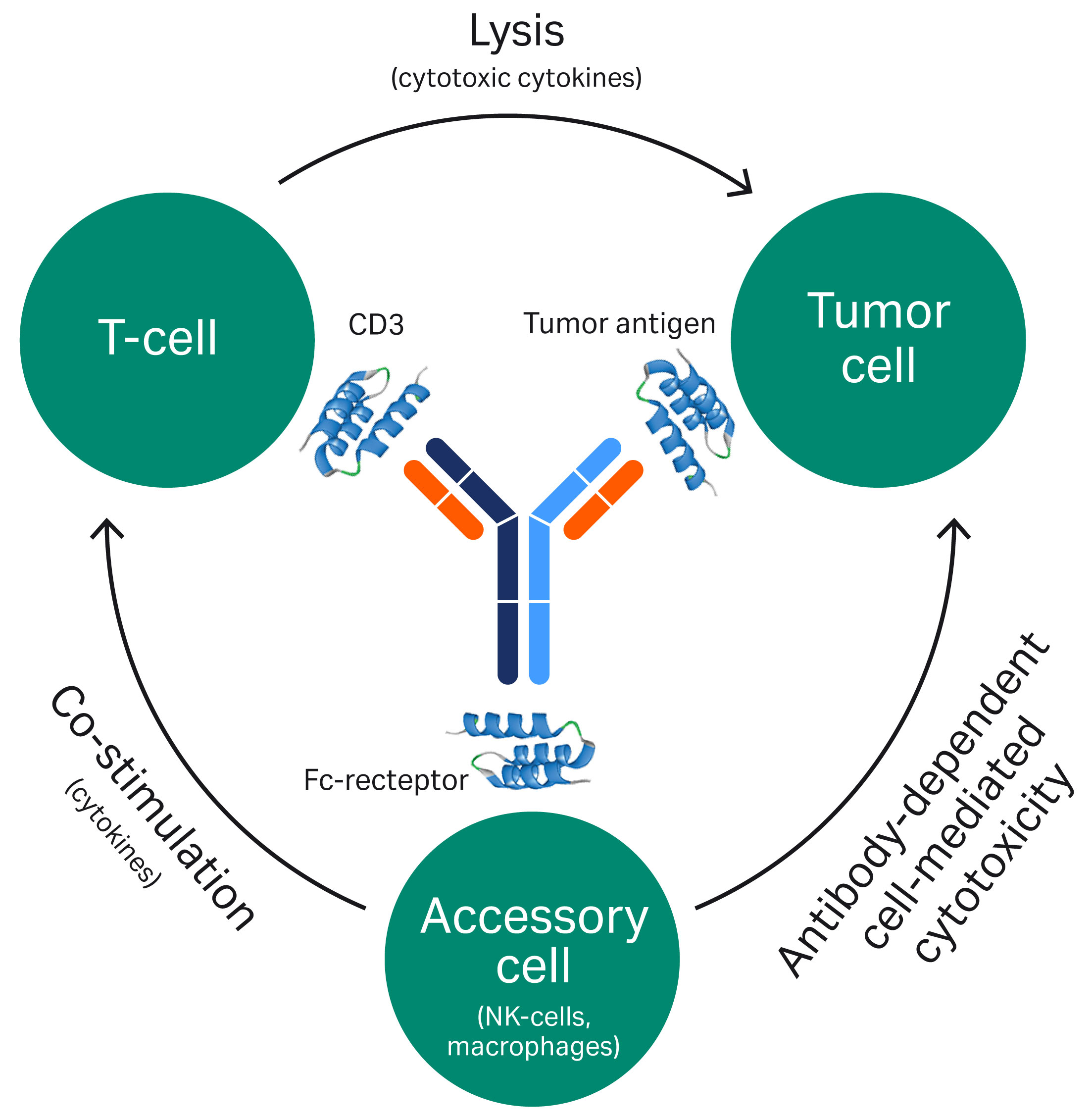
(i) BsAb 来源于单克隆抗体 (mAb) (ii) BsAb 至少有两个针对不同抗原的不同位点双重特异性意味着,例如,BsAb 可以使用一个抗原结合位点与靶细胞结合,并使用第二个抗原结合位点募集其他细胞或分子(图 1)。
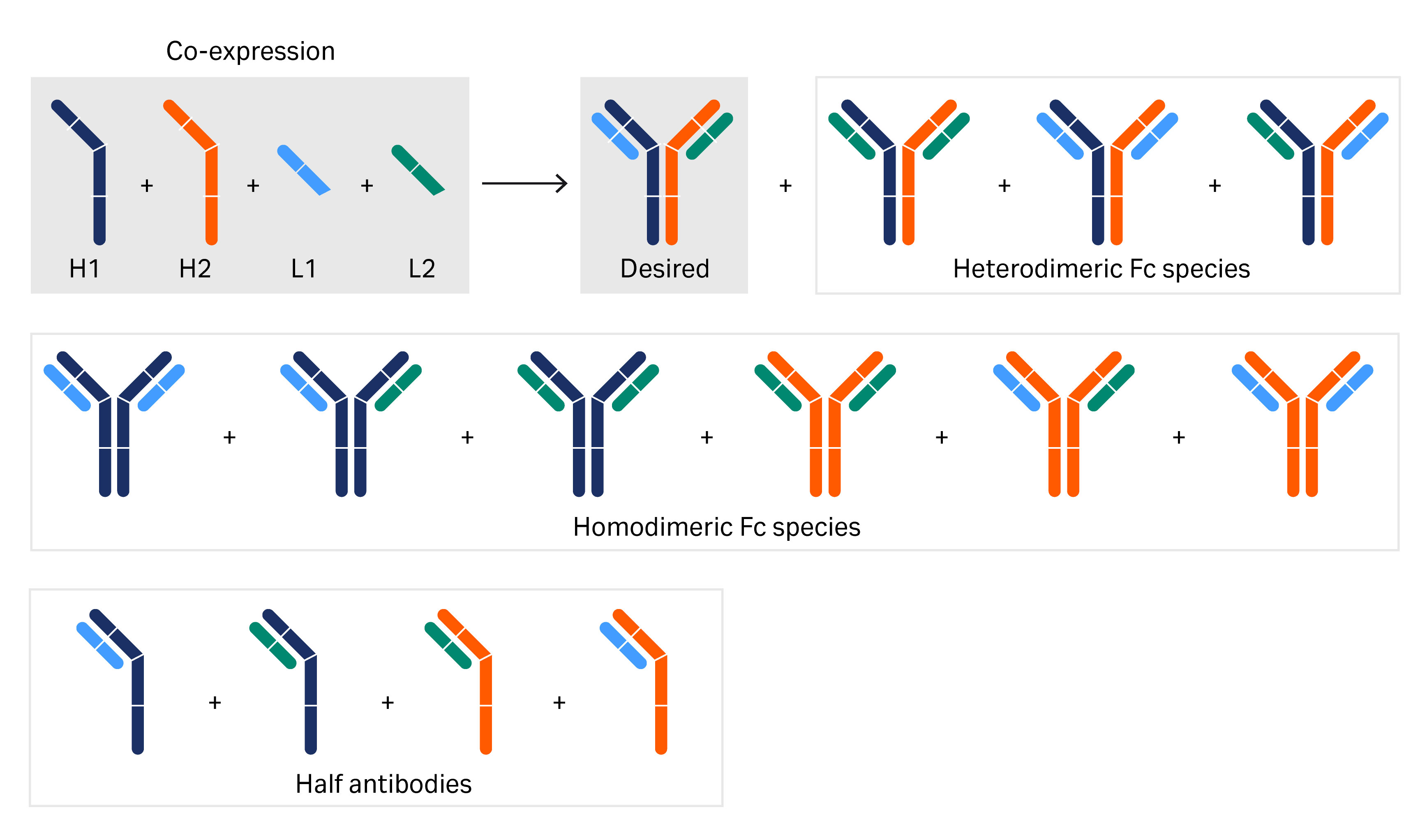
为了找到相关主要生物疗法 BsAb,需要筛选大量 BsAb 以找到相关主要候选抗体 (3)。通常需要多步纯化工艺(包括抗体纯化填料捕获步骤以及一个或两个额外纯化步骤),以去除与 BsAb 单体密切相关且源自目标 BsAb 的不良杂质(图 2)。本研究中使用的 BsAb 为三链 BsAb 异源二聚体,具有两个不同的重链 (HC) 和相同的轻链 (LC)。不同的链由不同的载体表达,并与细胞胞质溶胶中的最终 BsAb 分子结合。另一项挑战是处理为进一步临床研究而生产的大量候选 BsAb。
致力于以更少的步骤实现更有效的 BsAb 纯化
本工作的目的是提供一种快速工艺,用于早期从单个或部分组装的 BsAb 片段中筛选纯化候选 BsAb。
开展的研究是与 Celgene 合作,目的是找到更快速的方法,取代其三步亲和层析纯化方案。Celgene 现在的方法是对每种候选抗体分配几周时间,包括三步纯化:采用 MabSelect SuRe 的蛋白 A 捕获步骤、采用 Capto adhere 的多峰层析中间步骤和采用 Capto Phenyl ImpRes 的疏水层析精纯步骤—所有填料均来自 Cytiva。
设计了一种一步法替代原来的方法,目的是缩短得出结果的时间,而生产 BsAb 构建体所需的纯度 (> 90%) 和产率 (> 85%) 不变。
图 1. 双特异性 mAb 的作用方式示例。
图 2. 本文中研究的双特异性抗体的构建块和众多不同的基因工程变体。显示了重链和轻链区域以及一半抗体的各种组合。
材料和方法
样品
含 BsAb 的细胞培养补料由 Celgene, Inc. 提供。有关表达系统的信息归 Celgene, Inc. 所有。
捕获步骤的填料筛选
筛选了来自 Cytiva 的三种填料用于捕获步骤—MabSelect PrismA、MabSelect SuRe LX 和 MabSelect SuRe ppc。表 1 列出了产品及其在特定停留时间内相对动态结合载量的特性。筛选研究条件见表 2。
表 1. 用于蛋白 A 捕获步骤且纳入筛选的填料
| 填料 |
特性 |
|
在短停留时间 (RT) 和高耐碱稳定性下提供高动态结合载量 (DBC) 的蛋白 A 填料 |
|
|
提供高动态结合载量的蛋白 A 填料: |
|
|
在短 RT 下提供高动态结合载量的蛋白 A 填料: |
表 2. 筛选蛋白 A 捕获步骤所需填料的运行条件
| 样品 |
3 mL (0.35 g/L) 含 BsAb 的细胞培养补料 |
|
层析柱体积 |
1 mL |
|
平衡/结合缓冲液 |
PBS(磷酸盐缓冲液) |
|
洗涤液 |
10 柱体积 (CV) 25 mM 柠檬酸钠,pH 值 6 |
|
洗脱液 |
0% 至 100% 25 mM 柠檬酸钠,pH 值 3,20 柱体积 (CV) |
|
流速 |
0.25 mL/min |
分析
通过尺寸排阻层析 (SEC) 在 Superdex 200 Increase 10/300 GL 层析柱上测定 BsAb 纯度。使用 ÄKTA 层析系统实现了 SEC 的自动化。对峰进行积分,并测定全 BsAb、半抗体片段和 BsAb 聚集体的百分比。
结果
填料筛选
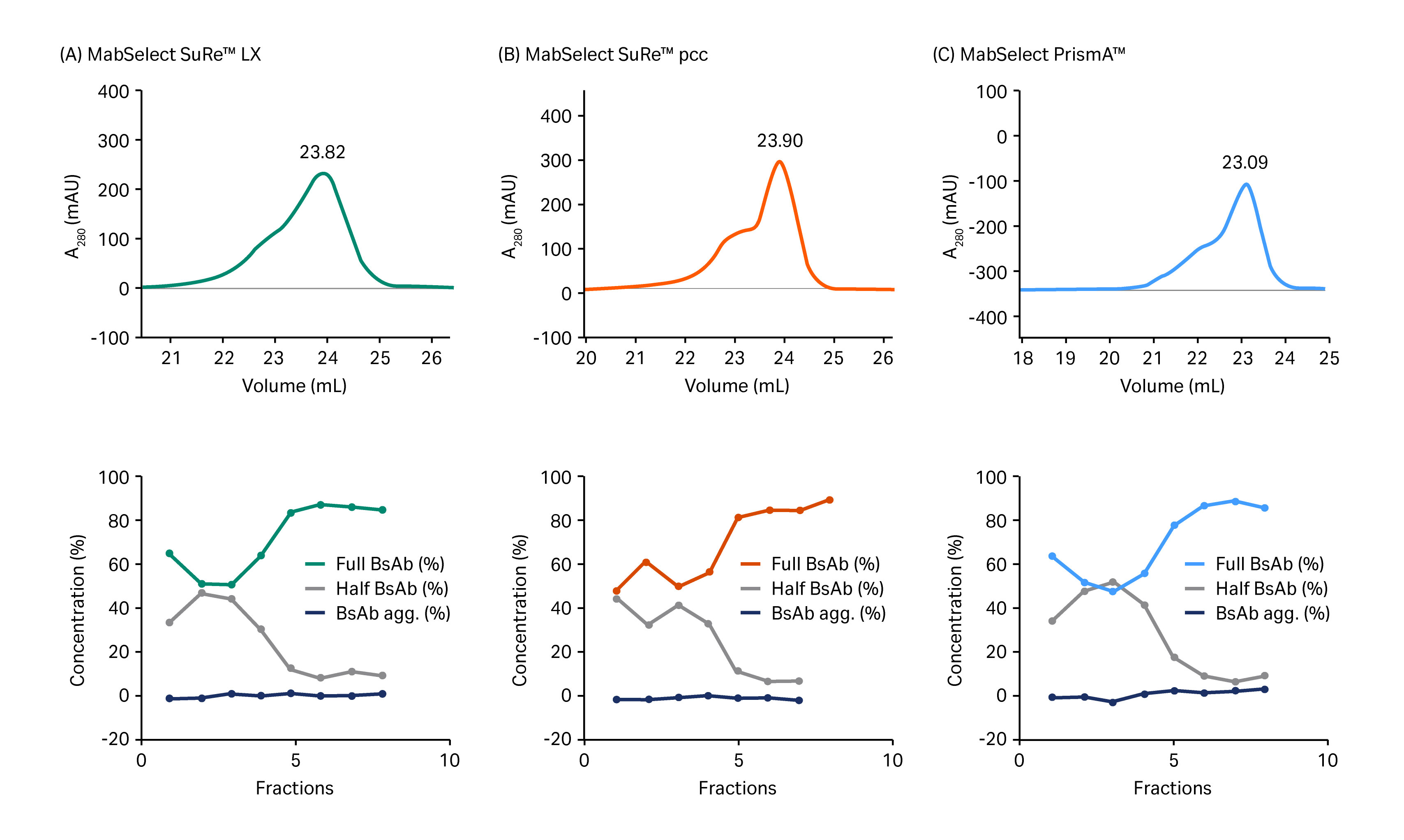
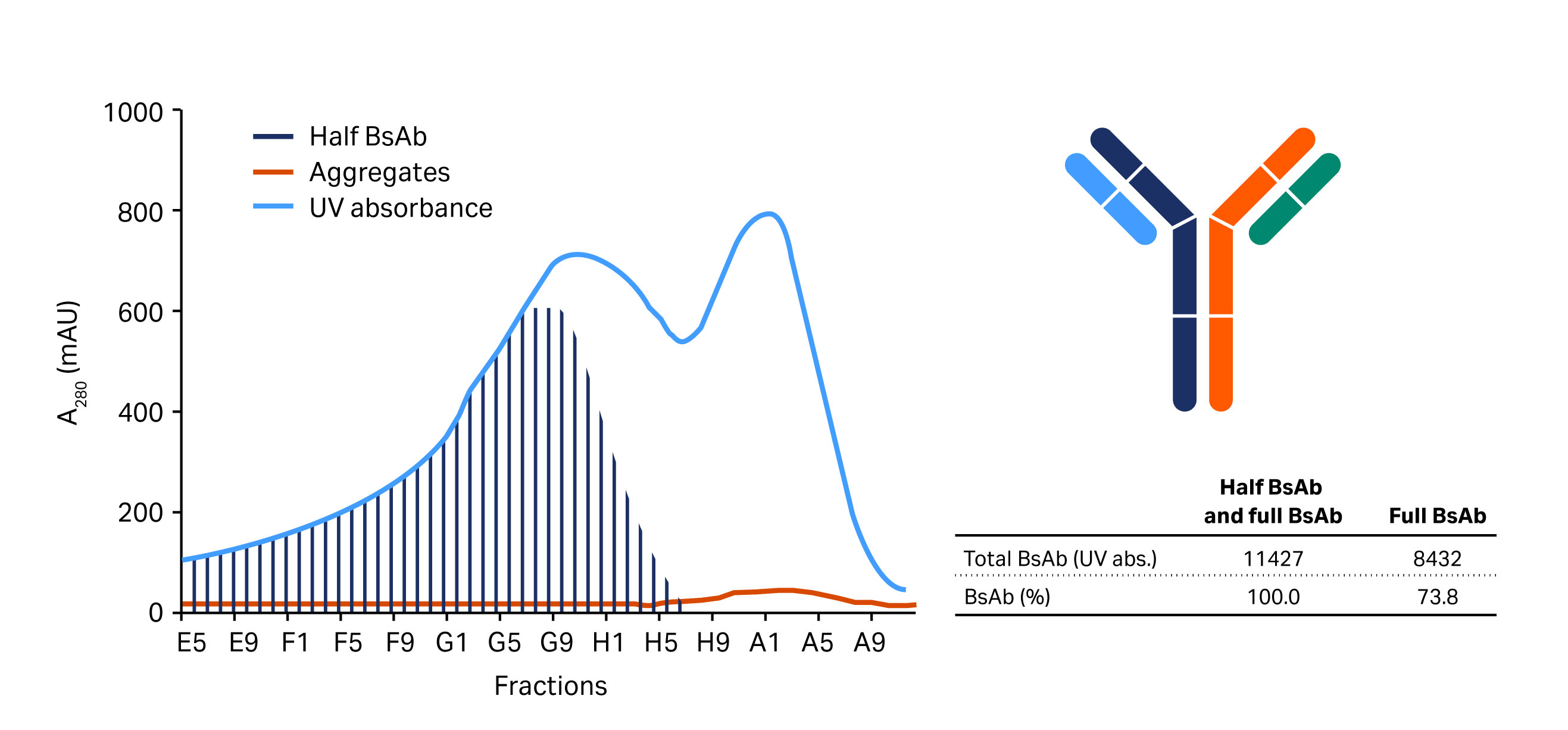
在筛选的蛋白 A 填料中,MabSelect SuRe pcc 的颗粒(填料)粒径最小(约 50 µm),其次是 MabSelect PrismA(约 60 µm)和 MabSelect SuRe LX(粒径最大(约 85 µm))。与预期一致,MabSelect SuRe pcc 和 MabSelect PrismA 的分辨率优于 MabSelect SuRe LX。最后选择 MabSelect PrismA 进入捕获步骤,因为其载量和耐碱稳定性高于 MabSelect SuRe pcc。图 3 显示了使用这些填料分离得到的层析图。
层析柱:Tricorn 5/50 (1 mL)
填料:MabSelect SuRe LX、MabSelect SuRe pcc、MabSelect PrismA
样品:3 mL (0.35 g/L) 含 BsAb 的细胞培养补料
平衡:PBS(磷酸盐缓冲液)
洗涤:25 mM 柠檬酸钠,pH 值 6
洗脱:0% 至 100% 25 mM 柠檬酸钠,pH 值 3,20 柱体积 (CV)
系统:ÄKTA avant 25
图 3. 上图显示了在 (A) MabSelect SuRe LX、(B) MabSelect SuRe pcc 和 (C) MabSelect PrismA 上从半抗体片段和 BsAb 聚集体中分离全 BsAb 所得的层析图。下图显示了通过尺寸排阻层析对与 (A) 中所示层析图中体积范围为 21.5 mL 至 25.0 mL 的组分进行分析的结果。
工艺验证
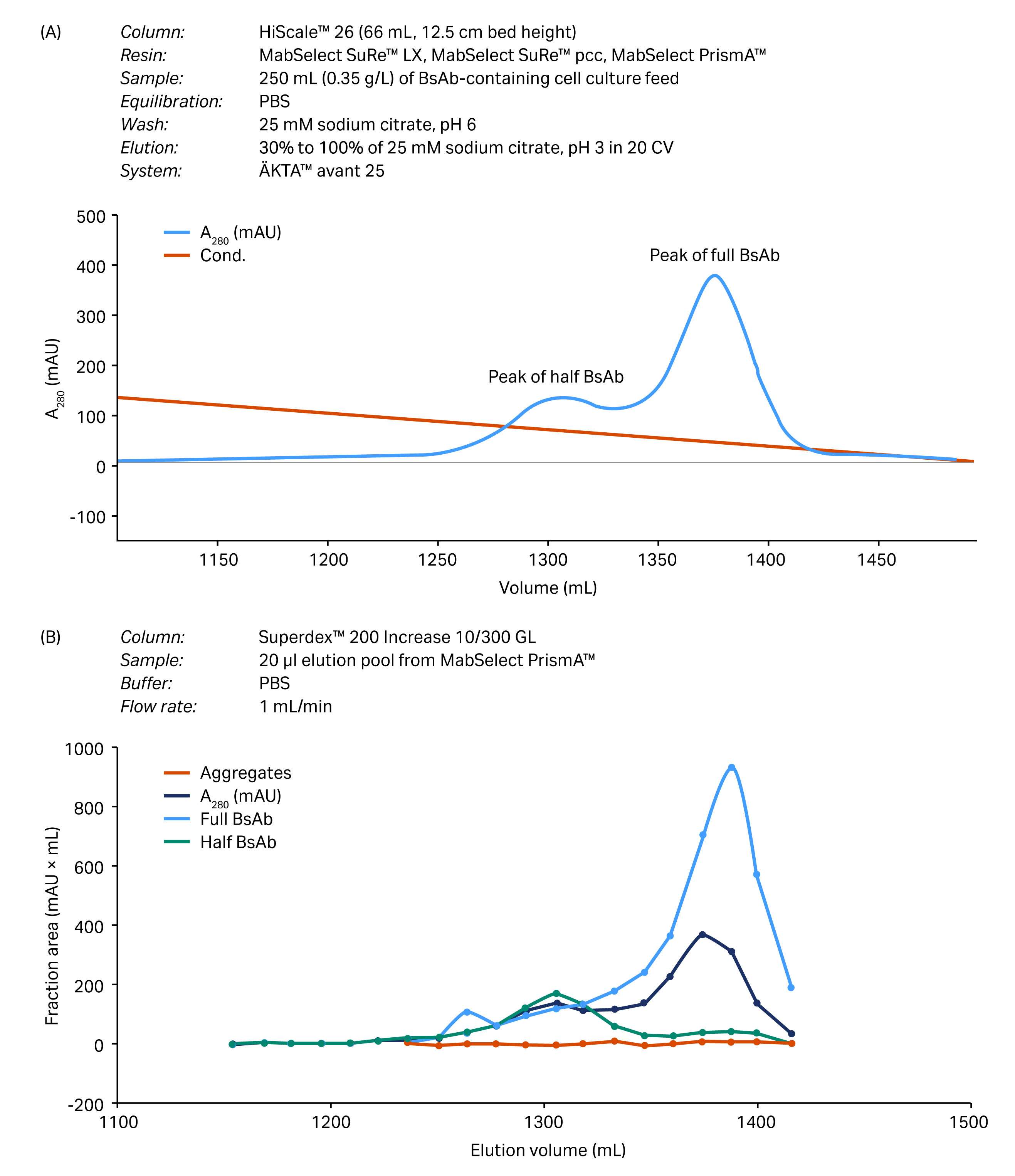
在大型层析柱(为工艺开发而设计)中评估了工艺验证(图 4)。根据曲线下面积的计算,回收率为 80% 时,BsAb 的纯度约为 95%。
(A)
层析柱:HiScale 26(66 mL,12.5 cm 柱床高度)
填料:MabSelect SuRe LX、MabSelect SuRe pcc、MabSelect PrismA
样品:250 mL (0.35 g/L) 含 BsAb 的细胞培养补料
平衡:PBS(磷酸盐缓冲液)
洗涤:25 mM 柠檬酸钠,pH 值 6
洗脱:30% 至 100% 25 mM 柠檬酸钠,pH 值 3,20 柱体积 (CV)
系统:ÄKTA avant 25
(B)
层析柱:Superdex 200 Increase 10/300 GL
样品:来自 MabSelect PrismA 的 20 µL 洗脱合并液
缓冲液:PBS(磷酸盐缓冲液)
流速:1 mL/min
图 4. 规模扩大至 HiScale 层析柱后捕获步骤的工艺验证。(A) 在 MabSelect PrismA 填料上分离全 BsAb、半 BsAb 和 BsAb 聚集体所得的层析图。(B) 使用分析 SEC 层析柱进行尺寸排阻层析(凝胶过滤层析法)分析所得的结果。
在相同条件下使用另外四种构建体进一步阐明了捕获步骤的结果。其中一种构建体的层析图见图 5。
图 5. 使用右侧显示的双特异性构建体/候选物验证新捕获步骤。在第二个峰中观察到该构建体的洗脱。第一个峰为半 mAb。
在预填充有 MabSelect PrismA 填料的 PreDictor 96 孔微孔板上进行方法优化。使用 Assist 软件进行方法优化。使用 Assist 软件研究缓冲液组分、pH 值、添加剂和梯度陡度。缓冲液条件和 BsAb 单体的所得产量和回收率见表 3。分析了来自 PreDictor 96 孔板的流通组分的单体浓度、产量和纯度,并与对照条件(即 25 mM 柠檬酸盐缓冲液,pH 值 3)进行比较(表 3)。
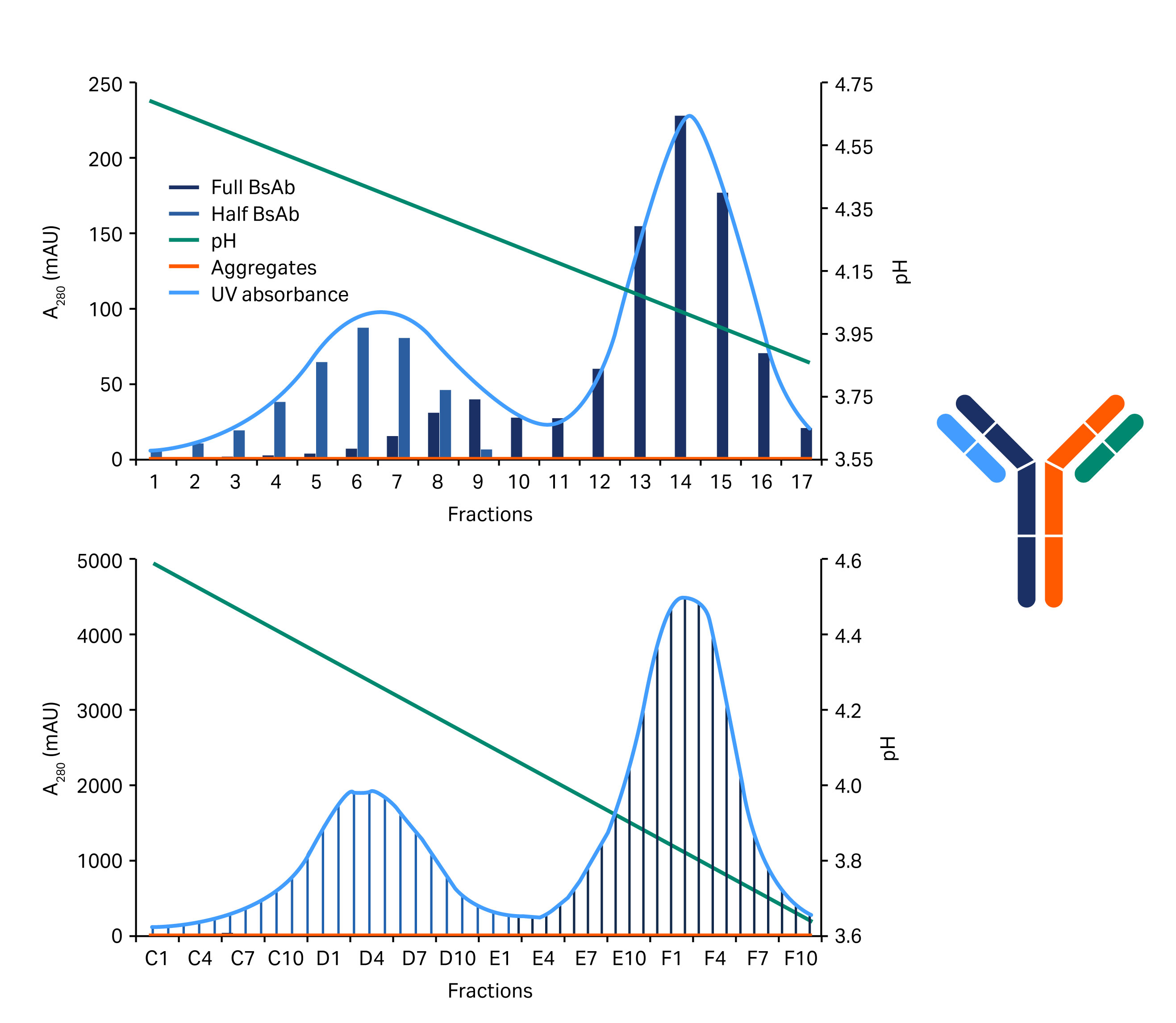
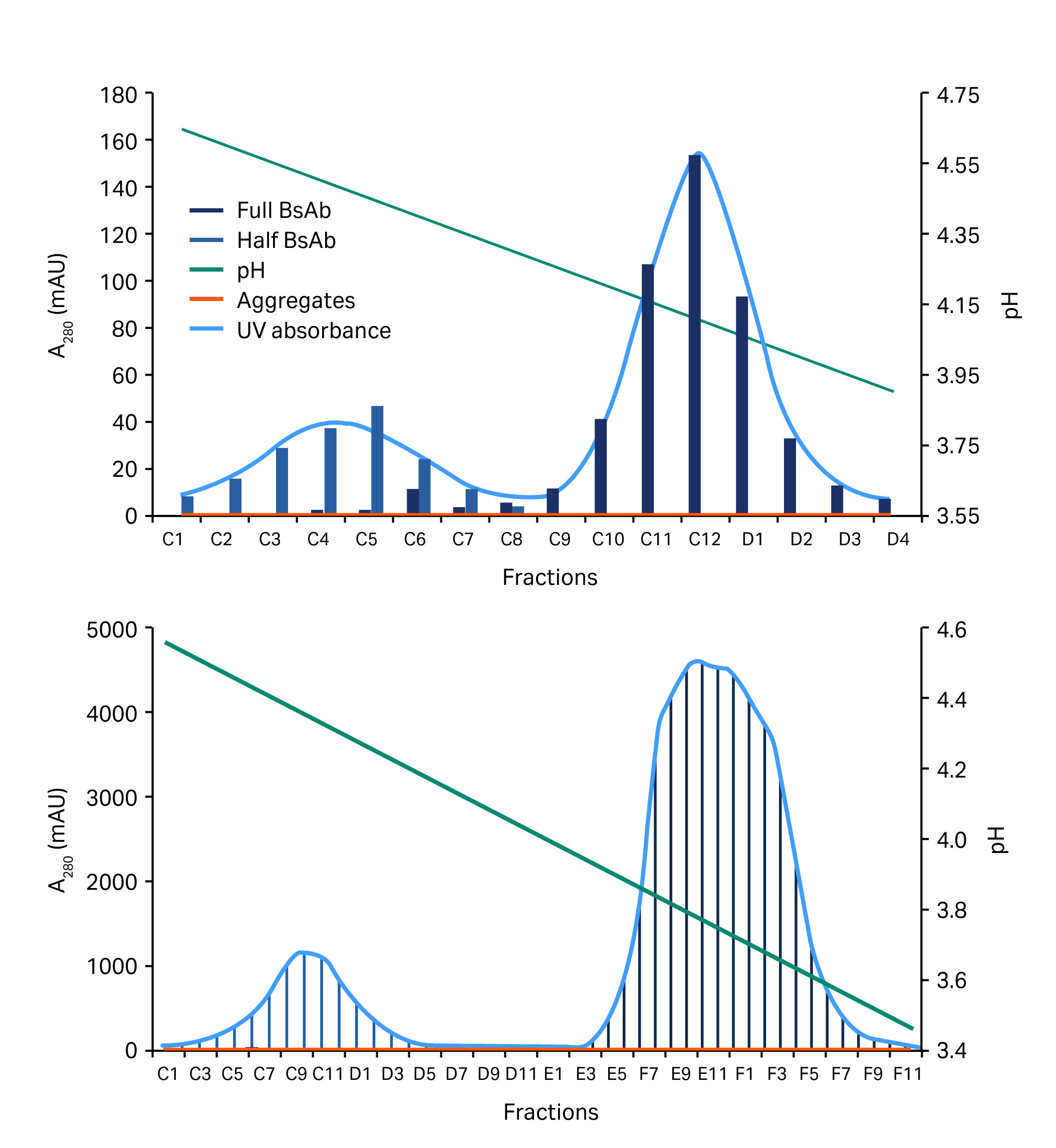
0.1 M 醋酸盐缓冲液(pH 值 3)的结果略好,并在层析柱运行中进行了验证。在该运行中,采用较浅的梯度。总梯度超过 40 柱体积 (CV)。该新方案已成功用于低载量和高载量下两种不同四链构建体的纯化(图 6 和图 7)。
表 3. MabSelect PrismA 上 BsAb 单体的缓冲液条件、回收率和产量的优化
| 缓冲液 | BsAb 单体 (%) | 单体(对照品百分比,%) | 产量 (µg) | 产量(对照品百分比) | 总单体回收率,µg(单体 × 产量) | 总单体回收率(对照品百分比) |
|---|---|---|---|---|---|---|
| 25 mM 柠檬酸盐,pH 值 3.0 | 89.9 | 100 | 55.4 | 100 | 49.8 | 100 |
| 100 mM 醋酸盐,pH 值 3.0 | 96.0 | 107 | 59.0 | 107 | 56.6 | 114 |
| 100 mM 醋酸盐,pH 值 3.5 | 95.0 | 106 | 57.0 | 103 | 54.1 | 109 |
| 100 mM 柠檬酸盐,pH 值 3.25 | 95.3 | 106 | 58.0 | 105 | 55.2 | 111 |
| 100 mM 柠檬酸盐、250 mM NaCl,pH 值 3.25 | 95.0 | 106 | 57.0 | 103 | 54.1 | 109 |
| 100 mM 甘氨酸,pH 值 3.0 | 94.0 | 105 | 56.0 | 101 | 52.8 | 106 |
图 6. 显示分离右侧所示构建体半 BsAb 和全长 BsAb(蓝色/灰色区域)变体的层析图。上面的层析图显示低样品载量,下面的层析图显示高样品载量。
图 7. 显示低(上图)和高(下图)样品载量下分离半 BsAb 和全长 BsAb(蓝色/灰色区域)的层析图。
结论
在初始捕获步骤中,MabSelect PrismA 提供了 BsAb 与未组装片段的良好分离。不同蛋白 A 填料和洗脱条件的快速筛选有助于开发一步纯化方案。与最初的三步工艺相比,实施新的一步法后,各候选物的工艺时间缩短了 4 至 6 周。使用两种不同构建体验证了工艺的适用性,纯度和产率均符合 > 90% 纯度和 > 85% 产率的设定要求。
了解有关 MabSelect 蛋白 A 填料的更多信息。
参考文献
- Fan, G. et al. Bispecific antibodies and their applications.J. Hematol.Oncol.8, 130 (2015).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4687327/
- Muller, D. and Kontermann, R. E. Bispecific antibodies for cancer immunotherapy: Current perspectives.BioDrugs 24(2), 89–98 (2010).https://www.ncbi.nlm.nih.gov/pubmed/20199124?dopt=Abstract
- Zwolak, A. et al. Rapid Purification of human bispecific antibodies via selective modulation of protein A binding.Sci. Rep. 7, article no. 15521 (2017).https://www.nature.com/articles/s41598-017-15748-0
致谢
我们感谢 Celgene, Inc. 为我们提供靶分子并分享数据。