作者:Sheffali Dash、Michelle Sabourin、Jichu Li 和 Paula Ravnikar
简介
细胞系开发往往是药物开发的一个关键环节。这是一个复杂的、劳动强度大的多步骤过程。我们的细胞系开发平台使用 GOCHO™ 宿主细胞系,可以极大地降低开发高性能克隆的风险和时限,提高生产效率。然而,当从静态培养转变为悬浮培养时,在扩增过程中可能会损失多个微池或克隆。在本研究中,我们探索了减少微池和克隆损失的替代方法,以改善工艺的总体结果。在细胞系开发工作流程中,转染后 48 小时开始选择微池。通过一系列扩增步骤,将微池或克隆逐渐扩增为更大的体积,并对生产率进行排序。我们对相关参数进行了研究,以实现最佳扩增和确定从静态培养转变为振荡培养的最佳时间。通过采用新的工作流程,我们将总体时限缩短了约 2 周,并在流加批次培养中轻松获得了产量 > 4 g/L 的多个克隆。这种新工作流程比我们以前的工作流程更可靠,并增加了我们获得高产克隆的机会。
新的微池选择和扩增工作流程显示出更高的回收率
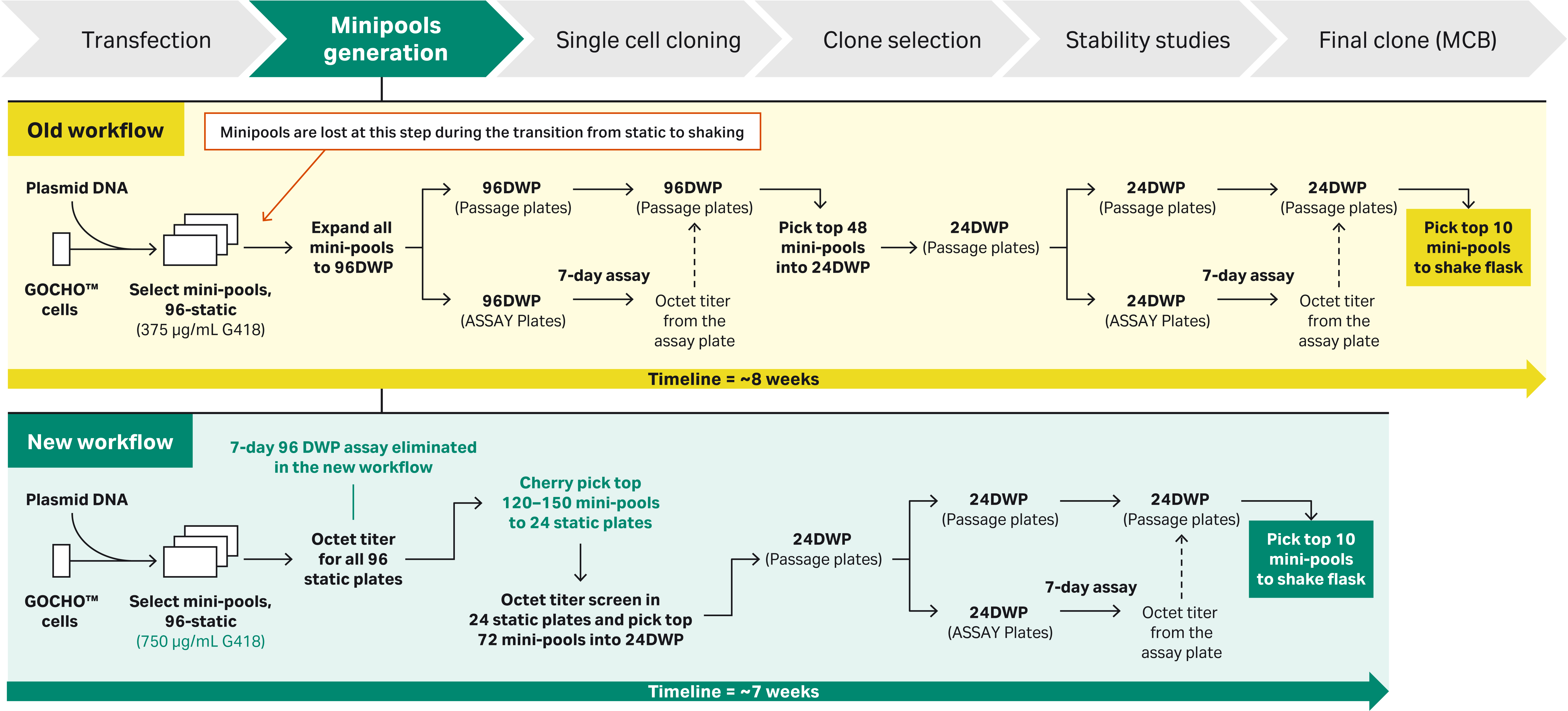
图 1. 用于微池选择工艺的 CLD 工作流程:a) 使用 96 DWP 生成微池的旧工作流程。b) 可在扩增期间极大地减少微池损失的新工作流程。
注:虽然该克隆扩增的新工作流程具有相似性,但在扩增期间从不同的微池中选择克隆可确保异质性。
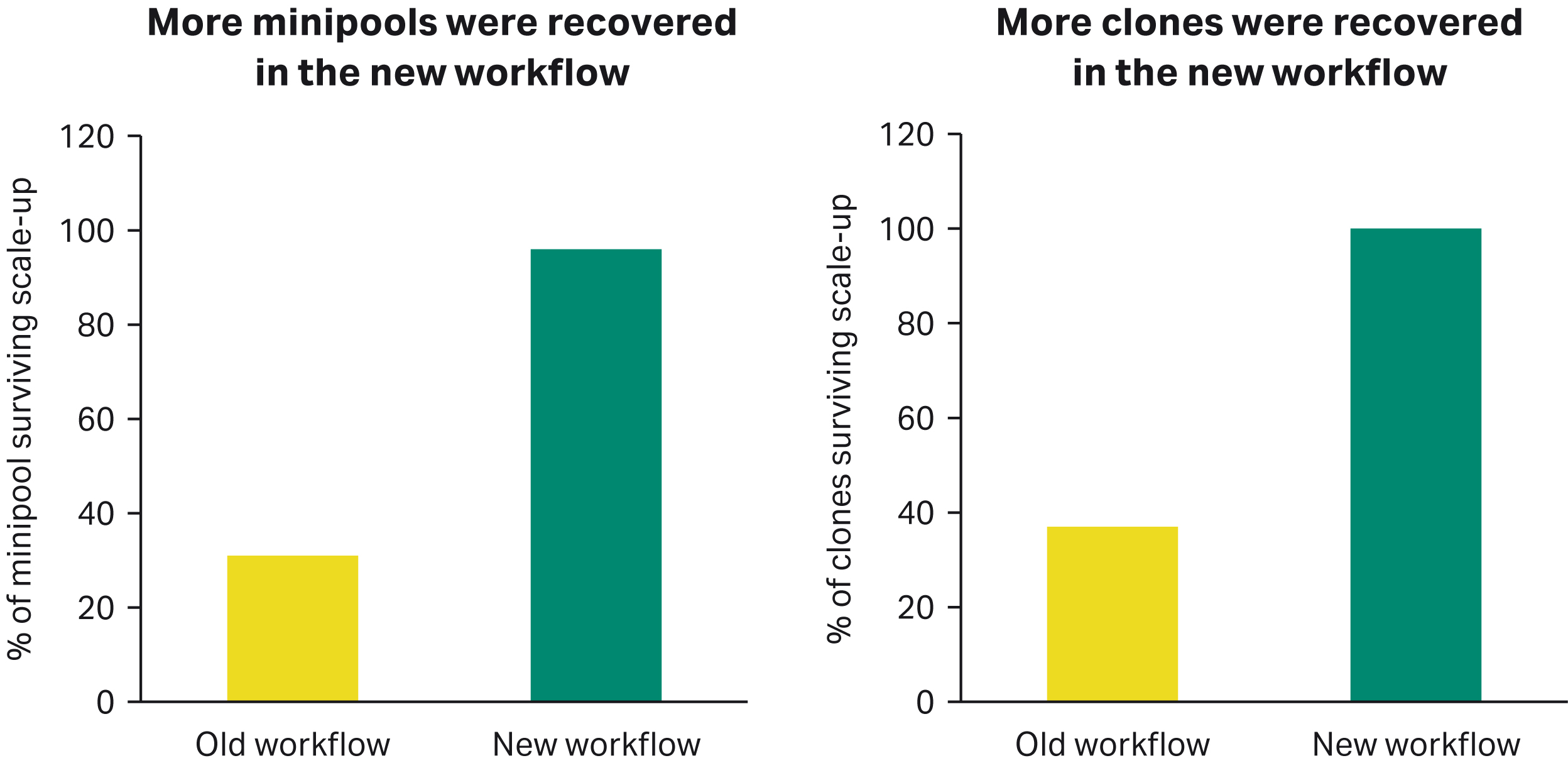
新工作流程中微池和克隆的回收率更高
新的工作流程中,在扩增阶段从 96 孔培养板中回收的微池和克隆更多(旧工作流程放大为 96深孔板 [DWP],新工作流程放大为 24 孔培养板)。
(A) (B)
图 2. 扩增期间使用 96 孔培养板时微池 (A) 和克隆 (B) 的生存百分比。
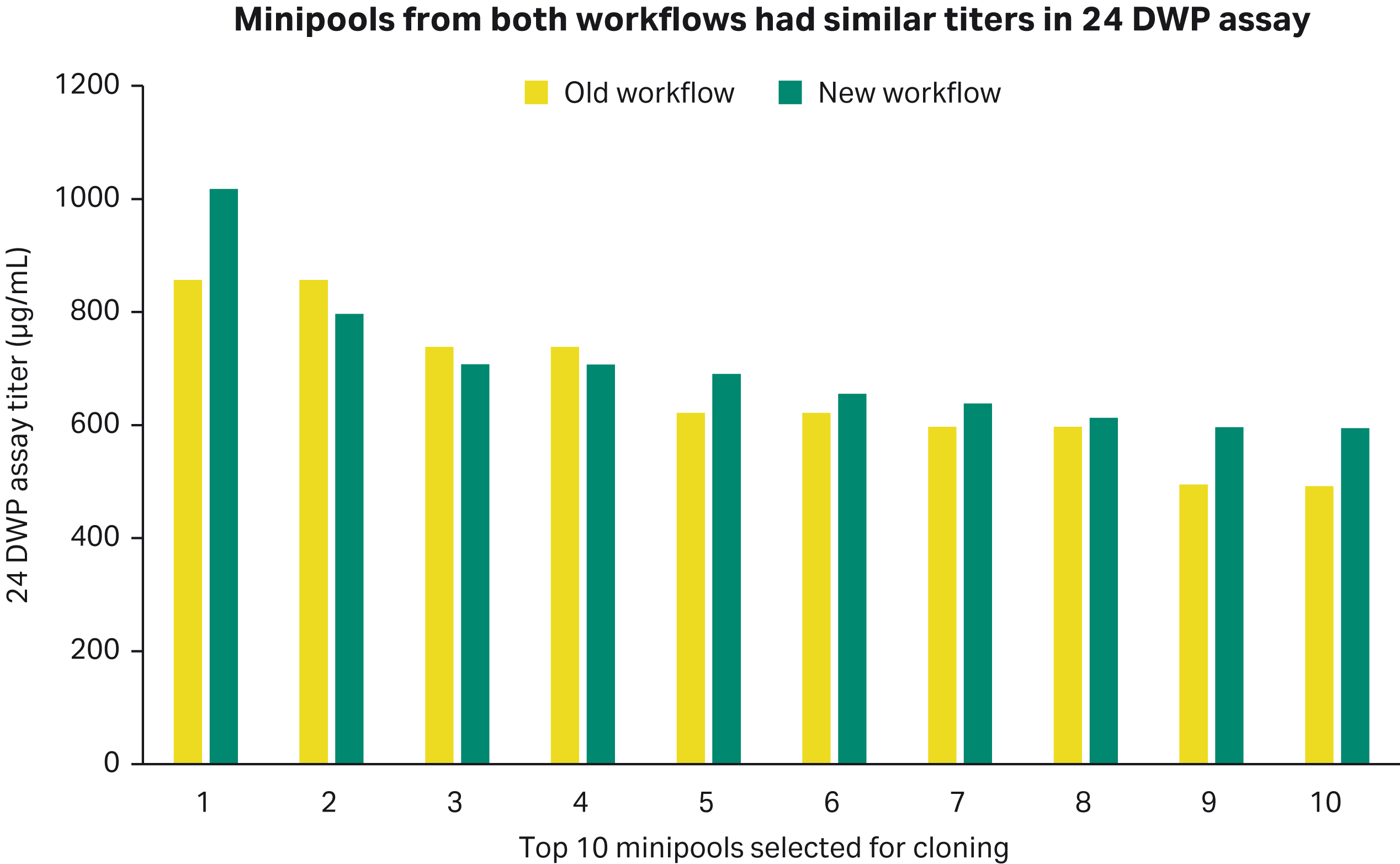
选出前 10 个优质微池进行单细胞克隆
分析两种工作流程分别对应的24孔培养板的7天试验结果,微池滴度看起来相似。使用 Cytena™ 的 single-cell printer™ 在 96 孔培养板的每个孔中放入 1 个细胞进行克隆,结果显示如下。
图 3. 两种工作流程生成的微池的 24 深孔板试验滴度。
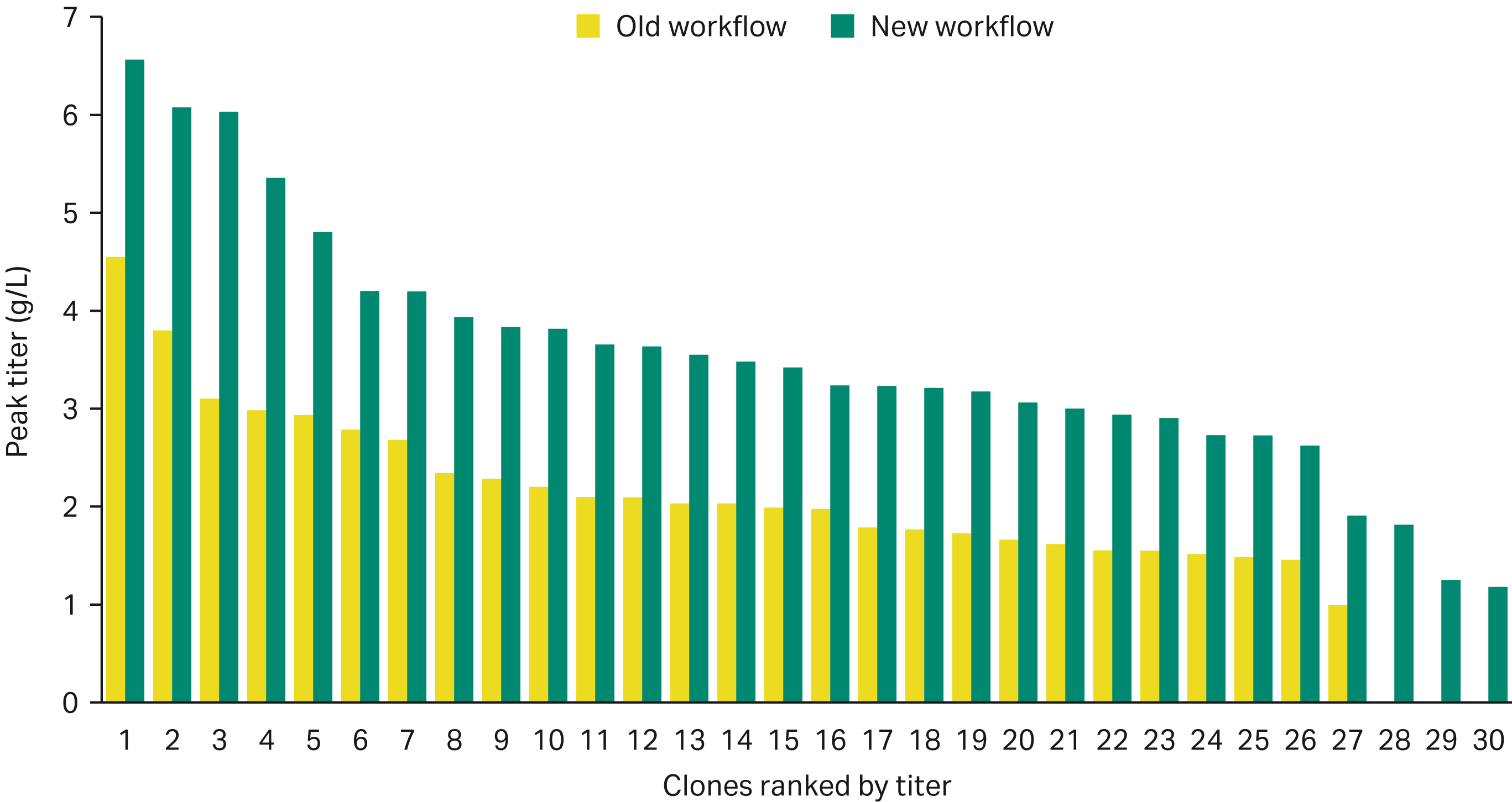
新工作流程获得了更高产量的克隆
通过 14 天流加批次试验对优质克隆进行了分析
通过新工作流程获得的克隆的生产率高于旧工作流程。这可能是因为扩增过程中克隆的回收率较高。产生该结果的原因可能是选用了更高水平的 G418 的缘故。
图 4. 通过新工作流程获得了产量更高的克隆,其中三个克隆在 流加批次培养14天时的产量 > 6 g/L。
| 滴度 |
旧工作流程 (克隆数量) |
新工作流程 (克隆数量) |
| 2-3 g/L | 11 | 6 |
| 3-4 g/L | 2 | 13 |
| 4-5 g/L | 1 | 3 |
| 5-6 g/L | 0 | 1 |
| >6 g/L | 0 | 3 |
表 1. 使用两种工作流程获取的克隆在流加批次培养14天时滴度的比较。
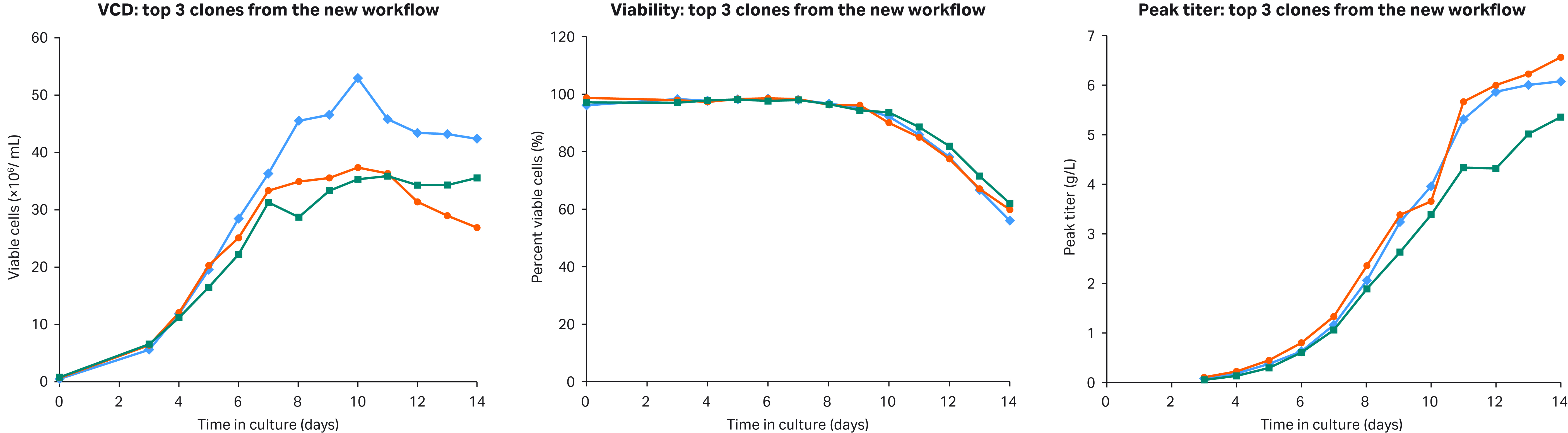
(A) (B) (C)
图 5. 上图所示为通过新工作流程获得的前三个优质克隆的 VCD (A)、活力 (B) 和滴度 (C) 曲线。
未来的工作
- 使用其他分子确认新工作流程的可靠性。
- 目前正在评估新工作流程获得的克隆的长期稳定性,并将与使用旧工作流程获得的克隆进行稳定性比较。
结论
- 我们在流加批次培养中获得了多个产量 > 4 g/L 的克隆,这些克隆可通过工艺开发进一步优化。来自这两个微池的三个克隆的产量 > 6 g/L。
- 在所述新工作流程中,由于在选择步骤和克隆步骤中取消了 96 深孔板的 7 天试验,我们将总体时限缩短了约 2 周。
- 新工艺更为可靠,因为从扩增工艺中回收的微池和克隆百分比更高,因而获得的克隆产量更高。