使用蛋白 L 填料捕获双特异性抗体并去除产品相关杂质
随着双抗、偶联物和片段等抗体变体从临床前阶段转入商业化生产,生物医疗生产线正在变得越来越多样化。在这些变体中,有很多变体,尤其是非对称双特异性抗体,往往会在细胞培养期间聚合或形成同源二聚体和半抗体等产品相关杂质。这些杂质间的相似性为下游工艺带来了额外挑战,尤其是捕获后的工艺。根据亲和力差异在捕获阶段进行精纯是一种潜在的解决方案。在此,我们给出了利用具有新选择性的 MabSelect™ VL 蛋白 L 填料进行复杂实体提纯的应用数据。
简介
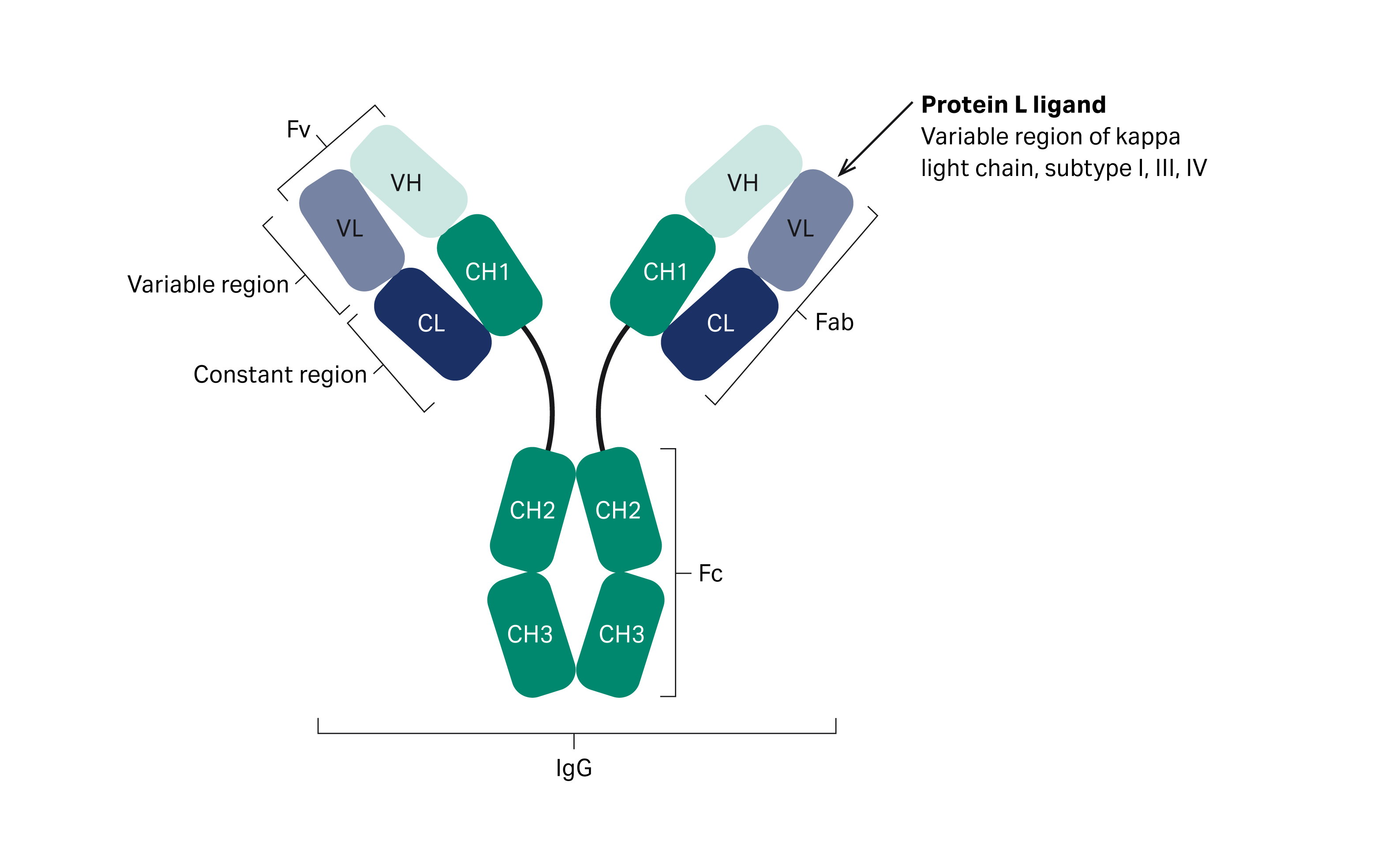
MabSelect™ VL 亲和填料采用蛋白 L 配基,它对人抗体 κ 轻链的可变区具有非常强的亲和力(图 1)。本填料为双特异性抗体 (bsAb) 以及含 κ 轻链的抗体片段的亲和捕获赋予了高生产力。它还针对不与蛋白 A 结合的抗体变体提出了一种有效的替代捕获方法。与之前的填料相比,本填料的动态结合载量 (DBC) 和耐碱稳定性大幅提升,非常适合作为捕获抗体变体的经济高效的手段。MabSelect™ VL 填料具有良好的分辨率,可以有效地分离双特异性抗体捕获过程中的产品相关杂质,并可作为高度纯化抗体变体的工具。本文介绍从错配同源二聚体中分离双特异性抗体的典型应用。
抗体结构
图 1. 抗体的结构。箭头指向为蛋白 L 与抗体发生相互作用的位置。
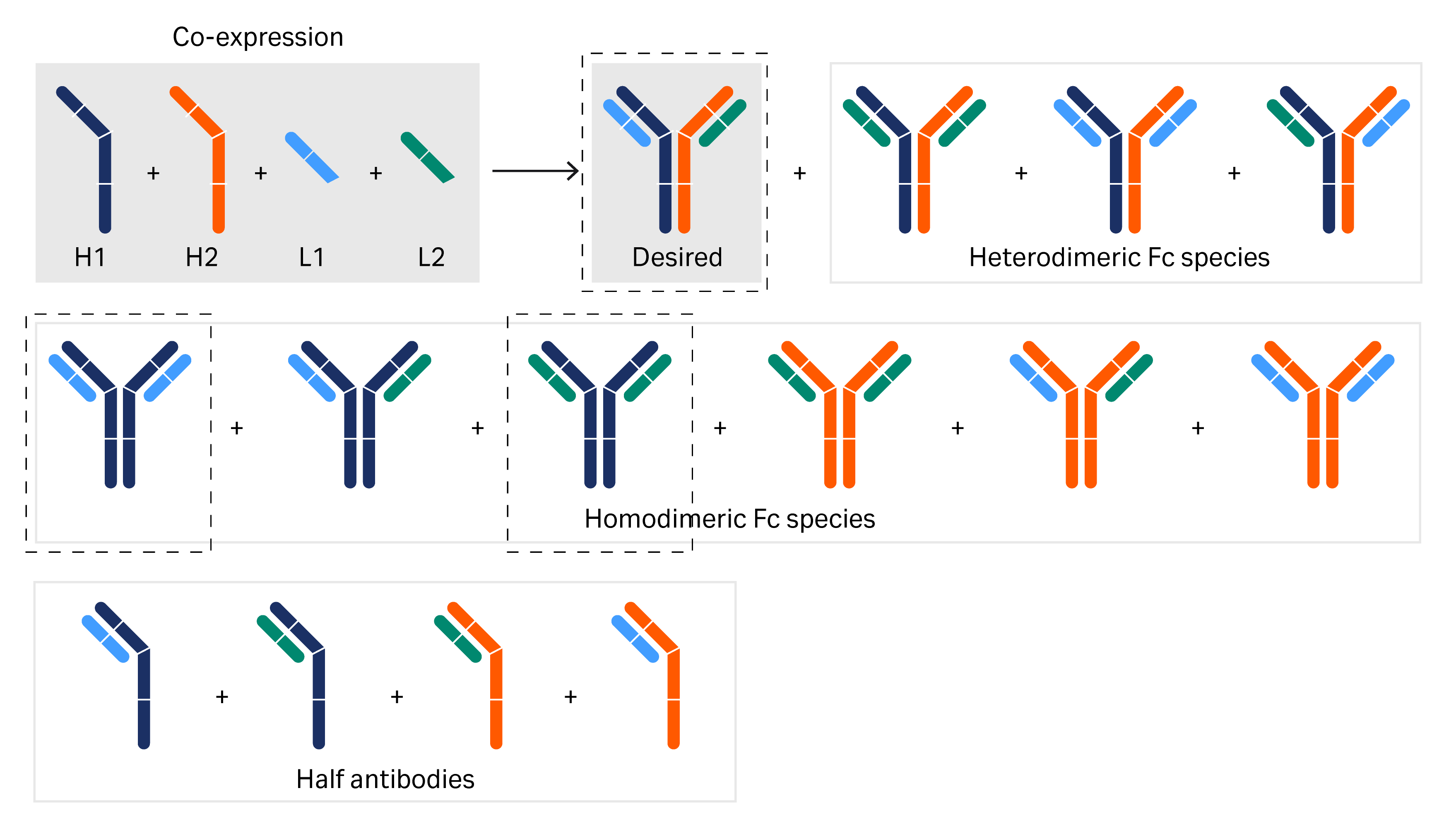
四链 bsAb 的轻重链区域以及代表所需 bsAb 和产品相关杂质的半抗体能够形成多种组合(图 2)。产品相关杂质的类型和数量取决于组合技术,例如用于生产不对称分子的 Fc 异源二聚体、Knobs-into-holes 技术、CrossMAb™ 技术,或用于正确配对轻重链的轻链法。
图 2. 双特异性 mAb 表达中轻重链区域的可能组合。下述示例介绍了所需双特异性分子和错配同源二聚体的分离。
分离 bsAb 和错配同源二聚体的 pH 值洗脱法
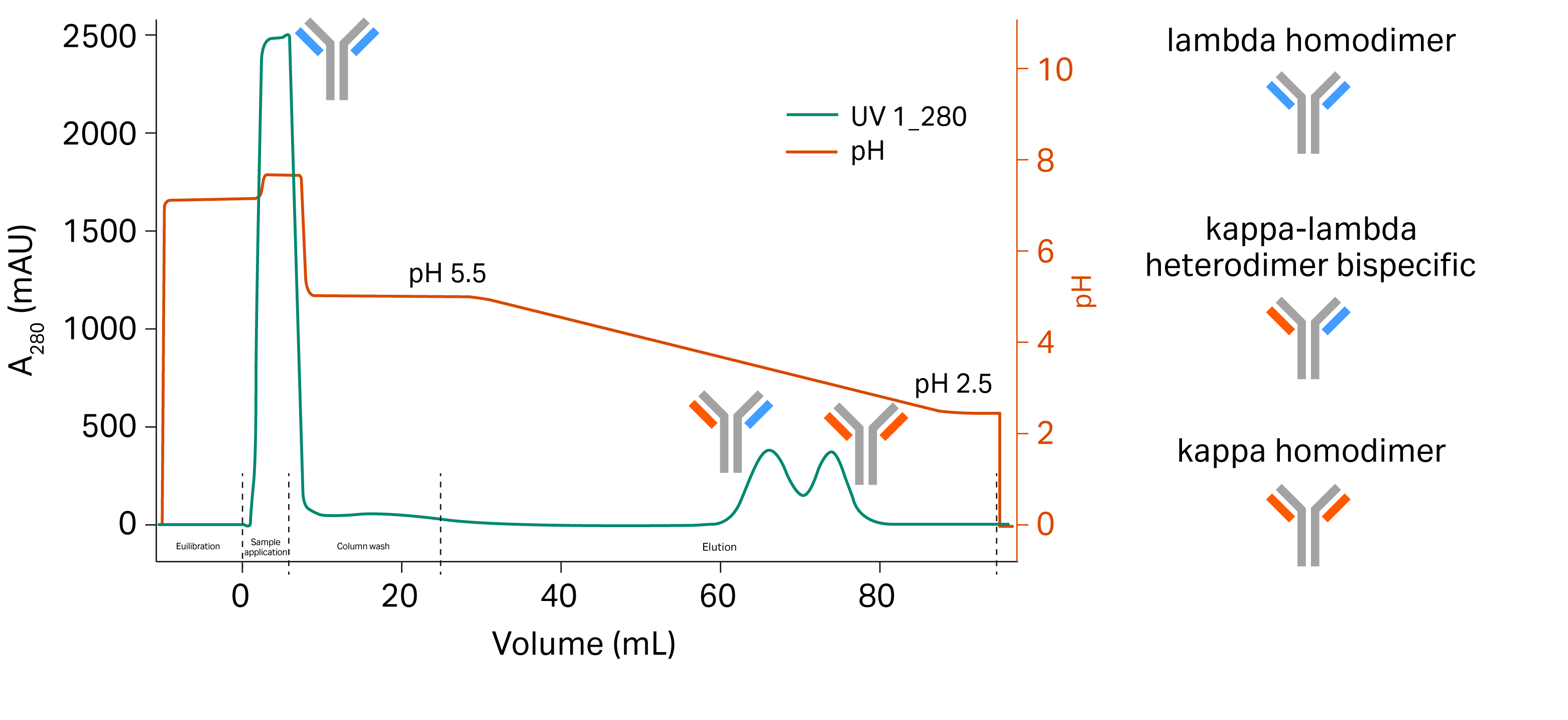
MabSelect™ VL 层析填料专门用于结合 IgG 单克隆抗体变体的 kappa 类轻链,可在捕获步骤分离目标分子与错配分子。我们根据 κ 轻链和 λ 轻链以及亲和力差异进行分离评估,采用的上料组合物包括一条 κ 轻链(曲妥珠单抗 κ1 类抗 HER2 轻链)、一条 λ 轻链(阿维单抗 λ2 类抗 PDL1 轻链)和一条 FC 链(抗 HER2 重链 1 和 2)(Thermo Fisher Scientific)。这三条链分别以 30:30:40 的比例表达。
首先,在装填 MabSelect™ VL 填料的 Tricorn™ 5/100 层析柱中上样 5 mg 的双特异性细胞培养液,根据梯度洗脱法(pH 值范围从 5 到 2.5)测量双特异性 κ-λ 异源二聚体和错配 kappa 同源二聚体的洗脱 pH 值(图 3)。在洗脱梯度期间收集组分,并采用液相层析质谱法 (LC-MS) 进行分析,以此确认不同实体的分离情况。Mispaired lambda homodimers do not bind to the column as they do not contain any kappa light chains and can be found in the flowthrough.由于错配 kappa 同源二聚体和 κ-λ 异源二聚体双特异体的亲和力差异,所有两者可采用梯度洗脱法(pH 值范围从 5 到 2.5)分离。
图 3. 梯度 pH 值洗脱法从错配同源二聚体中分离出所需的 bsAb。
为进一步了解 MabSelect™ VL 从细胞培养收获物的错配同源二聚体中分离双特异性 κ-λ 轻链 mAb 异源二聚体的性能,对 pH 值分步洗脱的效果进行了测试。对装填 MabSelect™ VL 填料的不同形式的层析柱进行分步洗脱。在 Tricorn™ 5/100 层析柱、HiTrap™ 1 mL 层析柱和 HiScreen™ 层析柱中分别上样 5 mg 双特异性细胞培养收获物、2.5 mg 双特异性细胞培养收获物和 12 mg 样本。
结果
bsAb 样本梯度洗脱
使用装填于 Tricorn™ 5/100 层析柱的 MabSelect™ VL 填料进行线性梯度洗脱,从而得出分步洗脱法的洗脱 pH 值(图 4)。测试结果见表 2。MabSelect™ VL 在两大洗脱峰中的 pH 值相差 0.4。
层析柱:Tricorn™ 5/100
填料:MabSelect™ VL
样本:5 mL bsAb,流速为 0.250 mL/min,使用 Superloop™
平衡液:20 mM 磷酸钠,150 mM 氯化钠,pH 值为 7.2
洗涤液:10 CV 的 50 mM 柠檬酸盐,pH 值为 5.0,流速为 1 mL/min
梯度:20 CV 的 50 mM 柠檬酸盐 (0–100%),pH 值为 2.5,每步流速为 1 mL/min,然后使用 5 CV 的 50 mM 柠檬酸盐 (100%)
CIP:3 CV 的 0.1M 氢氧化钠,流速为 0.2 mL/min
系统:ÄKTA pure™
图 4 使用装填于 Tricorn™5/100 层析柱的 MabSelect™ VL 填料,在 ÄKTA pure™ 层析系统中绘制的线性梯度洗脱的层析图谱。
随后根据梯度洗脱(表 1)得出的洗脱 pH 值进行分步洗脱。分别使用 pH 值为 3.5 和 3.1 的 50 mM 柠檬酸盐进行第 1 步和第 2 步洗脱。
表 1. 梯度洗脱(pH 值范围从 5 到 2.5)得出的洗脱 pH 值。这些值将作为 50 mM 柠檬酸盐洗脱缓冲液(pH 值为 2.5)的分步洗脱设定值 (%B)。
| 填料 | 层析柱 | 洗脱 pH 值峰 1 | %B 峰 1 | 洗脱 pH 值峰 2 | %B 峰 2 |
| MabSelect™ VL | Tricorn™ 5/100 | 3.5 | 65 | 3.1 | 79 |
图 5 所示为不同形式的层析柱的 MabSelect™ VL 的分步洗脱结果。结果表明,Tricorn™ 5/100 层析柱和 HiScreen™ 层析柱具有相似的洗脱曲线。与其他两个层析柱的洗脱峰相比,HiTrap™ 1 mL 层析柱的洗脱峰显示较慢且更宽。该结果在预料之中,因为与其他形式的层析柱相比,该层析柱的填料体积相对于 ÄKTA pure™ 系统的外水体积更小。由于外水体积比 HiTrap™ 1 mL 的体积更大,导致样本被稀释。所有三种形式的层析柱均分离了 bsAb 和 kappa 同源二聚体。
(A)
层析柱:Tricorn™ 5/100
填料:MabSelect™ VL
样本:5 mg 的 bsAb 细胞培养收获物
平衡液: 5 CV 的 20 mM 磷酸钠,150 mM 氯化钠,pH 值为 7.2,流速为 1 mL/min
洗涤液:10 CV 的 50 mM 柠檬酸盐,pH 值为 5.0,流速为 1 mL/min
洗脱:使用 50 mM 柠檬酸盐缓冲液(pH 值为 3.5 和 3.1),以 1 mL/min 的流速进行分步洗脱
CIP:3 CV 的 0.1 M 氢氧化钠,流速为 0.2 mL/min
系统:ÄKTA pure™
(B)
层析柱:HiTrap™ 层析柱 (1 mL)
样本:2.5 mg 的 bsAb 细胞培养收获物
平衡液:5 CV 的 20 mM 磷酸钠,150 mM 氯化钠,pH 值为 7.2,流速为 0.5 mL/min
洗涤液:10 CV 的 50 mM 柠檬酸盐,pH 值为 5.0,流速为 0.5 mL/min
洗脱:使用 50 mM 柠檬酸盐缓冲液(pH 值为 3.5 和 3.1),以 0.5 mL/min 的流速进行分步洗脱
CIP:3 CV 的 0.1 M 氢氧化钠,流速为 0.1 mL/min
系统:ÄKTA pure™
(C)
层析柱:HiScreen™ 层析柱
样本:12 mg 的 bsAb 细胞培养收获物
平衡液:5 CV 的 20 mM 磷酸钠,150 mM 氯化钠,pH 值为 7.2,流速为 2.3 mL/min
洗涤液:10 CV 的 50 mM 柠檬酸盐,pH 值为 5.0,流速为 2.3 mL/min
洗脱:使用 50 mM 柠檬酸盐缓冲液(pH 值为 3.5 和 3.1),以 2.3 mL/min 的流速进行分步洗脱
CIP:3 CV 的 0.1 M 氢氧化钠,流速为 0.47 mL/min
系统:ÄKTA pure™
图 5. bsAb 样本纯化的层析图谱,分别使用装填于 (A) Tricorn™ 5/100 层析柱(深蓝色线)、(B) HiTrap™ 1 mL 层析柱(浅蓝色线),和 (C) HiScreen™ 层析柱(绿色线)的 MabSelect™ VL 填料,并使用 50 mM 柠檬酸盐缓冲液(pH 值为 3.5 和 3.1)进行分步洗脱。
洗脱组分 LC-MS 分析
使用 LC-MS 法分析组分,从而确认产品相关杂质(如同源二聚体和半抗体)得以分离。
在使用 FabRICATOR® (IdeS, Genovis AB) 进行 LC-MS 分析之前,先处理用于梯度洗脱和分步洗脱的样本。Fc/2 片段存在于所有组分中,其对应的峰值分子量 (Mr) 约为 25,000(图 6)。A12 组分包括与 bsAb MW 相匹配的主峰,约为 Mr 97,000。B3 组分包括 bsAb (Mr 96,970) 和 kappa 同源二聚体 (Mr 97,600),但是也包括更小的片段(Mr 23,600 和 46,200),可能是可变轻链 (VL) 和二聚化 VL。剩余组分(B4、B5 和 B6)仅包含 kappa 同源二聚体,不含 bsAb。VL 和二聚化 VL 等片段分别存在于 B4 组分和 B6 组分中。
结果表明,错配 kappa 同源二聚体和 K-λ 异源二聚体的双特异性 mAb 都得到了有效分离,对此 LC-MS 分析法从不同洗脱组分中分离出 Mr 97,000 和 97,600 可以证明。数据也表明,bsAb 不仅可以提纯自 kappa 同源二聚体,还可以分离自样本的单聚体 VL 和二聚体 VL。
图 6. 使用 MabSelect™ VL 填料进行 bsAb 样本梯度洗脱的 LC-MS 组分数据。
图 8 和图 9 显示了图 7 所示分步洗脱组分的 LC-MS 分析结果。分步洗脱标志着错配 kappa 同源二聚体和 K-λ 同源二聚体 bsAb 实现了基线分离。从梯度洗脱和分步洗脱的 LC-MS 数据中可以看出,bsAb 明显从杂质(如错配 kappa 同源二聚体和单聚体 VL 和二聚体 VL)中分离了出来。
层析柱:Tricorn™ 5/100
填料:MabSelect™ VL
样本:bsAb
样本上样量:5 mg
起始缓冲液:20 mM 磷酸钠,150 mM 氯化钠,pH 值为 7.2
洗涤液:50 mM 柠檬酸盐,pH 值为 5.0
洗脱缓冲液:50 mM 柠檬酸盐缓冲液
流速:1 mL/min
梯度:分步梯度洗脱,pH 值为 3.5 和 3.1
系统:ÄKTA pure™
检测:UV 280
图 7. bsAb 分步洗脱层析图谱(带组分 ID),使用装填于 Tricorn™ 5/100 的 MabSelect™ VL 层析填料。
图 8. A5 组分的分步洗脱 LC-MS 数据,其中显示了 Fc/2 的 MW (Mr 25,000) 和 K-λ 异源二聚体 bsAb 的 MW (M r 97,000)。
图 9. C2 组分的分步洗脱 LC-MS 数据,其中显示了 Fc/2 的 MW (Mr 25,000) 和错配 kappa 同源二聚体的 MW (M r 97,600)。
结论
我们已经证明:
- 鉴于 K-λ 异源二聚体 bsAb 和杂质(kappa 同源二聚体和 VL)的亲和力差异,MabSelect™ VL 能够将二者分离。可以在梯度 pH 值洗脱的首个洗脱峰收集到所需的 bsAb。由于 kappa 同源二聚体和 VL 域与填料的结合性更强,所以洗脱较慢,在第二峰完成洗脱。
- 具有两个静态 pH 值的分步洗脱让 K-λ 异源二聚体 bsAb 和细胞培养收获物的杂质实现了基线分离。
- MabSelect™ VL 使用不同形式的层析柱(Tricorn™ 5/100、HiTrap™ 1 mL 和 HiScreen™)进行分步 pH 值洗脱的分辨率具有可比性。与其他两个层析柱的洗脱峰相比,HiTrap™ 1 mL 层析柱的洗脱峰显示较慢且更宽。该结果在预料之中,因为与其他形式的层析柱相比,该层析柱的填料体积相对于 ÄKTA pure™ 系统的外水体积更小。所有三种形式的层析柱均实现了 bsAb 和 kappa 同源二聚体的基线分离。
使用装填于 Tricorn™ 5/100 层析柱的 MabSelect™ VL 填料进行线性梯度洗脱,从而获得最佳的洗脱 pH 值。随后对装填有 MabSelect™ VL 填料的不同形式的层析柱进行分步洗脱,从而对比性能(表 4)。表 3 中列出了梯度洗脱和分步洗脱所用的缓冲液。进行线性梯度洗脱和分步洗脱时均采用了 ÄKTA pure™ 层析系统和预编程的 UNICORN™ 软件。
表 3. 梯度洗脱和分步洗脱所使用的缓冲液。
| 缓冲液 | 组成成分 |
| A1(平衡缓冲液) | 20 mM 磷酸钠,150 mM 氯化钠,pH 值为 7.2 |
| A2(洗涤缓冲液) | 50 mM 柠檬酸盐,pH 值 5.0 |
| B1(洗脱缓冲液) | 50 mM 柠檬酸盐,pH 值 2.5 |
| A3 (CIP) | 100 mM NaOH |
表 4. 基于梯度洗脱结果的分步洗脱设置
| 层析柱 | %B 第 1 步 | 柱体积 (CV) | %B 第 2 步 | 柱体积 (CV) |
| Tricorn™ 5/100 层析柱 (2 mL) | 65 | 8 | 79 | 5 |
| HiTrap™ 层析柱 (1 mL) | 65 | 8 | 79 | 8 |
| HiScreen™ 层析柱 (4.7 mL) | 65 | 8 | 79 | 8 |
洗脱组分 LC-MS 分析
为了进一步确认产品相关杂质(例如同源二聚体和半抗体)在分步洗脱时得以分离,采用 LC-MS 分析法对 MabSelect™ VL 分步洗脱得出的洗脱峰 1 和洗脱峰 2 的组分进行分析,从而确定洗脱池中不同实体的质量。将 5 mg bsAb 样本加到 Tricorn™ 5/100 层析柱中的 MabSelect™ VL 中,并在使用 100 mM 氢氧化钠进行 CIP 之前实施分步梯度洗脱,包括去除液(100 mM 柠檬酸,pH 值为 2.1)和 Milli-Q 洗涤液。对选定组分进行 LC-MS 分析。
在对 bsAb 样本酶切进行 LC-MS 分析之前,先对样本进行 FabRICATOR® (IdeS, Genovis AB) 处理。将样本与酶混合培养 3 小时,并进行 LC-MS 分析。在采取 MS 分离技术之前,先以梯度为 0.1% 的甲酸和乙腈溶剂中的 0.1% 甲酸为缓冲液,进行反相层析。使用高精度质谱可以检测同源二聚体和异源二聚体,以及小片段分子量。