疏水相互作用层析-HIC 预装填层析柱可用于捕获蛋白、中间纯化或精纯步骤
By Eva Heldin,Cytiva 生物工艺研发负责人
本文中,我们将展示并讨论利用疏水相互作用层析 (HIC) 纯化一种重组蛋白(在大肠杆菌中表达)的工作流程。我们的工作流程包括使用高通量工艺开发 (HTPD) 板帮助选择柱层析法的填料和初始条件。在本次研究中我们采用的缓冲液条件范围是根据初步溶解度研究的结果确定的,使用的所有填料为 Capto™ 高生产效率填料。根据获得的层析结果,我们发现洗脱步骤前采用的洗涤步骤减少了杂质数量。我们还进行了实验设计 (DoE) 优化洗涤步骤,并通过验证对结果进行了确认。
简介
在下游生物工艺所采用的典型三步层析纯化工艺中,第一步是捕获步骤。该步骤的目的是浓缩目的蛋白,使目的蛋白与有害的、宿主细胞衍生组分(例如蛋白酶)分离,避免使目的蛋白发生降解。第二步是中间纯化步骤,该步骤的作用是去除大量杂质。最后一个步骤是精纯步骤,用于去除更难去除的、与目标分子关系更密切的痕量杂质。重要的是确保利用正交法选择多步骤纯化方案所使用的技术,确保每个步骤能够利用目标分子的不同特征进行分离。
如果有适合目标分子(例如单克隆抗体)使用的亲和层析溶液,由于在经过第一个步骤之后纯度一般已经比较高了,因而可以减少对中间精纯步骤的需求。
在本研究中,我们重点讨论采用 HIC 的中间纯化步骤的工作流程开发(图 1,请参阅精纯层析指南,了解更多背景信息)。之所以选择 HIC 作为合适的分析技术,是因为它与第一个步骤(捕获步骤,即使用阳离子交换介质对材料进行处理)存在正交关系。在最后一步精纯中,可以使用阴离子交换或带阴离子基团的多模式层析帮助清除带负电荷的杂质,例如 DNA、病毒及前两个步骤中未去除的与产品有关的其他杂质。
图 1. 在本研究中我们重点讨论第二步工艺(中间纯化)的改善。
中间纯化工艺的工作流程概述
本研究中采用的重组蛋白样品中包含目标分子片段。该中间纯化步骤的重要目标之一是显著减少这些片段,同时尽可能地提高全长目的蛋白的收率。另外,由于理想的最终结果是实现分步大规模纯化工艺,因此本研究的另一个目标是确定分步洗脱的条件。我们首先采用梯度洗脱探索本研究后面的分步洗脱适用的最佳条件。由于蛋白的溶解度是决定纯化成功的关键所在,因此首先进行了蛋白溶解度研究。确定本研究使用哪种填料时,所选填料应能够选择性结合蛋白片段或目的蛋白,并以较高收率洗脱目的蛋白。由于结合/洗脱步骤受所用填料和缓冲液条件的影响,因此应同步对二者进行筛选。
中间纯化步骤采用的工艺开发工作流程如下:
- 溶解度研究
了解盐添加剂和 pH 值对于目的蛋白溶解度的影响情况。研究采用 96 孔紫外板。
- 结合条件的筛选和填料选择
为尽量减少样品的使用,使用 PreDictor™ 孔板通过静态结合实验进行筛选。通过溶解度研究来确定研究中使用的缓冲液工作条件范围,同时筛选了以下填料:Capto™ Butyl ImpRes、Capto™ Phenyl ImpRes 及 Capto™ Phenyl (High Sub)。最佳条件定义为与目的蛋白的结合力高,且洗脱组分中的片段含量低。
- 基于孔板结果的层析柱研究 — 结合载量
在层析柱研究中对结合条件最为理想的所选填料 (Capto™ Butyl ImpRes) 进行了进一步研究,以便确定该填料的动态结合载量。
- 基于孔板结果的层析柱研究 — 选择性研究
将 PreDictor™ 孔板研究所确定条件用于层析柱梯度洗脱研究。该研究的目的是验证洗脱步骤的盐浓度并评估选择性。研究结果表明,在洗脱前通过洗涤步骤是可以去除碎片的。
- 洗脱条件的筛选
之前步骤显示,与上样条件相比,pH 值和盐浓度都应进行调整。为了充分洗脱目的蛋白,我们使用 PreDictor™ 96 孔板,并通过改变洗脱缓冲液的 pH 值和盐浓度来筛选洗脱条件。
- 层析柱研究中的洗涤步骤优化
为了优化洗涤步骤,我们对盐浓度、上样量和洗涤时间等洗涤步骤条件进行了评估。以层析柱的形式,采用实验设计 (DoE)方法进行优化。采用了中心复合正交 (CCO) 设计,并通过统计评估确定了理想的条件。通过采用蒙特卡罗模拟,进一步验证了所确定条件的稳健性。
- 验证运行
将蒙特卡罗模拟所确定的条件用于验证层析柱实验,并从纯度和收率上对实验结果与预期值进行比较。
中间精纯步骤使用的起始材料
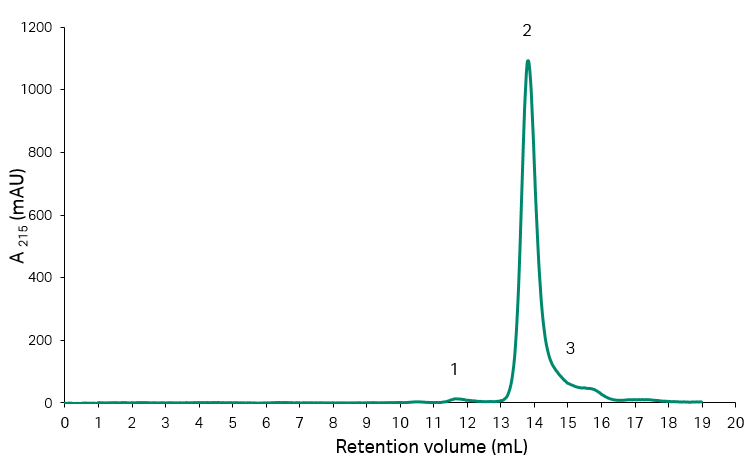
所述的实验起始材料是一种重组蛋白,其主要杂质为截断片段。由于杂质可以通过凝胶过滤层析 (SEC) 滤除,因此利用该技术分析起始材料以及在整个实验过程中收集的组分和合并液。对起始材料的分析结果如图 2 和表 1 所示,由此可以推断,片段的含量约相当于总蛋白含量的 14%。
层析柱:Superdex™ 200 Increase 10/300 GL
样品:使用阳离子交换介质预纯化的重组蛋白样品
上样量:20 µL
平衡缓冲液:PBS 缓冲液
流速:0.8 mL/min
系统:ÄKTA™ 系统
检测波长:215 nm
图 2. 用 Superdex™ 200 Increase 10/300 GL 层析柱对重组蛋白初始样品进行 SEC,并用紫外检测器在 215 nm 波长处进行分析。
表 1. 对 HIC 步骤初始材料进行 SEC 分析,所得的峰面积、面积百分比结果。
| 面积编号 | 峰面积 (mAU × mL) | 峰面积/总面积 (%) |
| 1(聚集体) | 7.40 | 1.0 |
| 2(主峰) | 617.7 | 85.7 |
| 3(片段) | 104.2 | 14.3 |
工艺开发步骤
本节详细介绍工艺开发工作流程的每个步骤。单击每个标题,以展开各个章节。
由于在纯化步骤中使用可溶性蛋白非常重要,因此需要首先研究蛋白的溶解度。缓冲液的 pH 值、盐类型和盐浓度等参数是影响蛋白溶解度的主要因素。
在本研究中检测了 96 孔板中蛋白的溶解度,蛋白所处的乙酸钠缓冲液 pH 值范围在 3.0 至 6.0 之间,并加入不同浓度的三种不同盐。评估所用的盐为氯化钠、硫酸钠和硫酸铵。缓冲液用 Tecan 工作站制备。
在 96 孔紫外板的每个孔中加入 180 µL 缓冲液,然后加入 20 µL 浓度为 16 mg/mL 的样品,使每个孔中的蛋白终浓度为 1.6 g/L。孔板在室温下孵育 30 分钟,然后用紫外检测器在 400 和 600 nm 波长处读取数值。在这两个波长下吸光度均增加,解释为蛋白出现沉淀。
结果
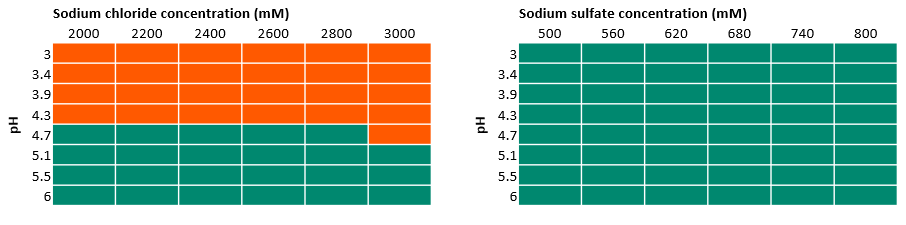
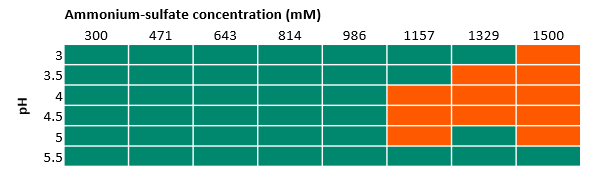
在图 3 和图 4 中,我们标出了所有被测缓冲液条件的紫外观测结果。橙色区域表示出现蛋白沉淀,可以观测到紫外吸光度增加,而绿色区域表示未观测到蛋白沉淀。该溶解度研究的观测结果如下:
- 由于在较低 pH 值下,氯化钠使蛋白的溶解度受到限制,因而在进一步实验中排除了该盐的使用。
- 硫酸铵在 1 M 的浓度下效果很好,而在更高的浓度下会使目的蛋白出现沉淀,如图 4 所示。于是在进一步实验中继续使用该盐(在盐浓度 <1 M 的条件下)。
- 硫酸钠在所有研究条件下同样表现良好,因此在进一步实验中也选择使用该盐。
图 3. 96 孔板实验结果,各孔含不同 pH 值、含不同浓度氯化钠和硫酸钠的 100 mM 醋酸盐缓冲液。吸光度在 400 和 600 nm 波长处测量。绿色表示无沉淀,而橙色表示有沉淀。
图 4. 96 孔板实验结果,各孔含不同 pH 值和不同浓度硫酸铵的 100 mM 醋酸盐缓冲液。吸光度在 400 和 600 nm 波长处测量。绿色表示无沉淀,而橙色表示有沉淀。
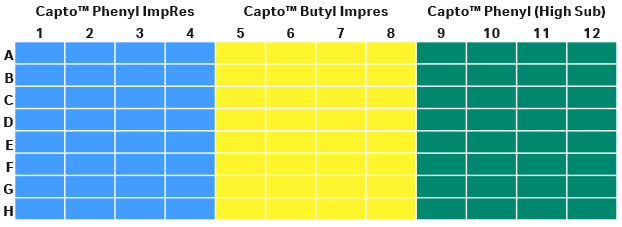
在该步骤中,我们通过改变盐的类型、盐浓度和 pH 值,并同时使用不同的填料来筛选缓冲液条件。由于研究中有四个可变的参数,因而 PreDictor™ 孔板是一个不错的选择。采用 PreDictor™ 96 孔板对具有不同疏水性的三种填料进行筛选。由于研究的目的是设计结合/洗脱精纯步骤,因而选择了高分离度的 Capto™ ImpRes 填料作为本研究的候选填料。PreDictor™ 孔板上的第三种填料是 Capto™ Phenyl (High Sub),旨在观察其对疏水性的影响。我们使用每个孔容纳 6 µL 填料的 PreDictor™ 孔板研究静态结合载量 (SBC),因为该板要求使用的蛋白样品量更少。孔板研究中填料的分布如图 5 所示。
该实验使用两块板进行,一块板上添加的盐为硫酸铵,另一块板上为硫酸钠。盐浓度的范围在 100 到 800 mM 之间,而 pH 值范围在 3.0 到 4.5 之间(醋酸盐缓冲液)。PreDictor™孔板在上样(体积为 200 µL)前进行平衡,使其达到各自的条件(浓度为 2.7g/L)。选择该浓度的目的是确保在孵育过程有过量的蛋白。将孔板置于定轨振荡器 (1100 rpm) 上孵育 60 分钟。通过离心分离(流穿组分)去除缓冲液,用紫外板收集缓冲液,然后在 237 和 276 nm 波长处测量所收集缓冲液的紫外吸光度。我们使用 Assist 软件评估测量结果。
如需更详细地了解操作过程信息,请参阅如何手动操作 PreDictor™ 孔板。
结果
我们观察发现,对于孔板研究中的 SBC,使用硫酸钠比使用硫酸铵高(此处未列出硫酸铵的数据)。另外,由于之前的捕获步骤中使用的就是硫酸钠,因此无需进行缓冲液置换。因此,我们选择硫酸钠进行进一步研究。在最优结合条件下(pH 值、盐和盐类型),Capto™ Butyl ImpRes 填料和 Capto™ Phenyl (High sub) 填料的 SBC 测定值都接近 40 g/L 填料(图 6)。但是,在检查非结合条件(即初步的良好洗脱条件)的孔板结果时,Capto™ Butyl ImpRes 更为理想,在低盐浓度条件下,几乎所有研究的 pH 值范围内,该填料的 SBC 都较低。另一方面,Capto™ Phenyl (High Sub) 的结合力太强,并且无法确定理想的洗脱条件。因此选择了 Capto™ Butyl ImpRes 填料进行该纯化。
图 5. SBC 研究中滤板所用填料的分布。
(A) Capto™ Phenyl ImpRes
(B) Capto™ Butyl ImpRes
(C) Capto™ Phenyl (High Sub)
图 6. mAb 在不同缓冲液成分中的静态结合载量(100 mM 醋酸盐缓冲液,pH 值 3.0 至 4.5,并添加 100 至 800 mM 硫酸钠)。(A) Capto™ Phenyl ImpRes,SBC 最大为 33 mg/mL 填料,(B) Capto™ Butyl ImpRes,SBC 最大为 39 mg/mL 填料,(C) Capto™ Phenyl (High Sub),SBC 最大为 39 mg/mL 填料。
在层析柱中进行第一次选择性研究之前,需首先确定蛋白样品的相关上样量。孔板研究的静态结合载量结果接近最大结合载量,但是如果使用动态处理层析柱进行纯化,应在相关的停留时间内测量结合载量。为此我们在 4 分钟停留时间内进行了前端分析,以测定 Capto™ Butyl ImpRes 填料对蛋白样品的动态结合载量 (DBC)。
该实验采用柱床高度 5.5 cm 的 Tricorn™ 5/50 层析柱。根据 PreDictor™ 孔板研究的结果,实验所采用的条件为 pH 值 3.0、100 mM 醋酸盐缓冲液,含 800 mM 硫酸钠。蛋白浓度为 2.0 mg/mL,并且实验采用了带有 Superloop™ 组件的 ÄKTA™ 层析系统,以便于大样本量上样。我们进行上样,直至流穿组分的吸光度达到上样蛋白溶液吸光度的 80%。使用 UNICORN™7 软件的扩展模块计算 DBC,计算结果汇总于表 2 中。
表 2. Capto™ Butyl ImpRes 填料对重组蛋白的 DBC 测定结果。
| QB5(5% 流穿率的 DBC) | 23.5 mg/mL 填料 |
| QB10(10% 流穿率的 DBC) | 24.2 mg/mL 填料 |
| QB80(80% 流穿率的 DBC) | 40.0 mg/mL 填料 |
进行第一次层析以评估填料对目的蛋白和杂质的选择性。针对蛋白的上样量,选择 10% 流穿率下 (QB10) DBC 的 50%。根据孔板研究的结果,利用 10 个柱体积 (CV) 的 800 mM 至 0 mM 的硫酸钠进行梯度洗脱,同时 pH 值从 3.0 增至 5.5。在洗脱过程中收集组分并使用 SEC 进行片段分析。
结果
我们发现,低分子量 (LMW) 片段在洗脱峰的前半部分被洗脱,表明在洗脱前采用洗涤步骤可以提高洗脱池的纯度(图 7)。由于目的蛋白在较晚的梯度中洗脱,为了防止目的蛋白从层析柱上洗脱,在洗涤步骤中应保持高盐浓度。目的蛋白在低盐条件下洗脱,这说明在分步洗脱过程中有可能在不添加盐的情况下洗脱目的蛋白。这与后面的精纯步骤可以起到双管齐下的作用。根据我们前面所做的条件筛选研究的结果,我们发现 pH 值有可能在洗脱中起到一定的作用。为此我们在接下来的静态洗脱研究中将洗脱缓冲液的 pH 值作为一个可变参数。
图 7. 使用 10 CV、800 mM 至 0 M 浓度梯度的硫酸钠溶液进行选择性研究。层析图谱中的第一个峰对应我们制备的第一批样品中的添加剂,但后来去除了该添加剂。
将使用 pH 值为 3 的 800 mM 硫酸钠处理的蛋白样品添加到装有 20 µL CaptoTM Butyl ImpRes 填料的 PreDictor™ 96 孔板的每个孔中。上样的蛋白量相当于填料在 QB10 下 DBC 的 50%。使用上样缓冲液洗涤后,用洗脱缓冲液进行三次洗脱。在洗脱过程中改变洗脱缓冲液的 pH 值和盐浓度。然后分析所有洗脱液,计算总收率。
结果
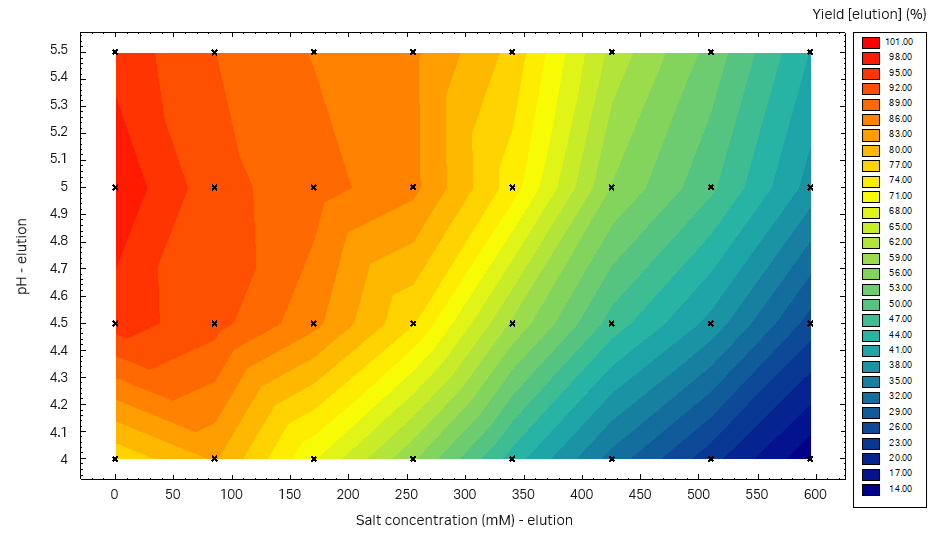
在 Capto™ Butyl ImpRes PreDictor™ 孔板研究中,当 pH 值在 4.5 至 5.5 之间时获得的收率最高(图 8)。我们决定使用 pH 值 5.5 进行洗脱,为了去除在洗脱峰前洗脱的 LMW 片段,我们还增加了洗涤步骤。洗涤步骤应在高盐浓度下进行,以避免洗脱目的蛋白。
图 8.Capto™ Butyl ImpRes PreDictor™ 孔板研究中三次连续洗脱过程中,在不同 pH 值-盐浓度下的收率。
洗涤步骤需要优化的参数为盐浓度和洗涤液体积。由于上样量对于分离度也很重要,因此本研究中也包括了上样量。在本研究中,我们选择了实验设计 (DoE) 方法确定最佳条件。通过采用实验设计 (DoE) 方式和 CCO 设计,我们可以优化条件,并发现所有参数之间的关系,而采用一次改变一个因子 (OFAT) 的方式是无法办到的。在实验设计 (DoE) 设置中,CCO 设计共进行了 17 次实验,如表 3 所示。这 17 次实验选择收率和纯度作为响应值,即监测结果。
结果
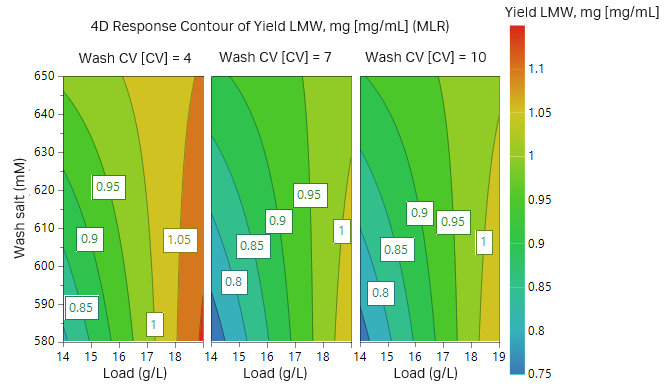
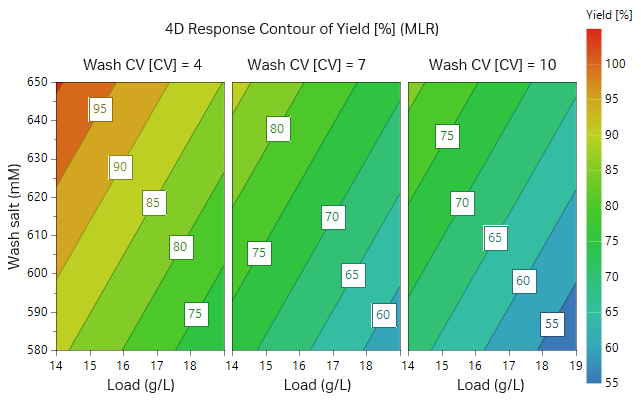
前 17 次实验的研究结果如图 9 和 10 的曲面图所示。经过对获得的模型进行统计数据稳健性检查后(收率和片段去除率均为 R2 < 0.9 和 Q2 > 0.8),该模型显示目的蛋白收率与纯度之间达到了平衡。从图中可以看出,在低盐浓度条件下,洗涤液量越高,获得的纯度越高。然而在这些条件下,收率比较低。经对实验设计 (DoE) 进行评估后,我们发现上样量最多不应超过 14g/L 填料,因此又降低上样量进行了两次实验(表 3,实验 18 和 19,未显示结果)。
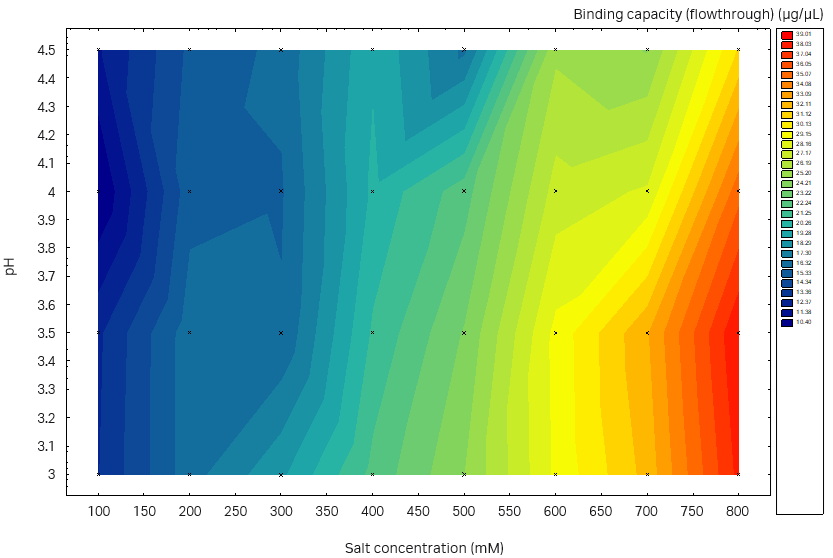
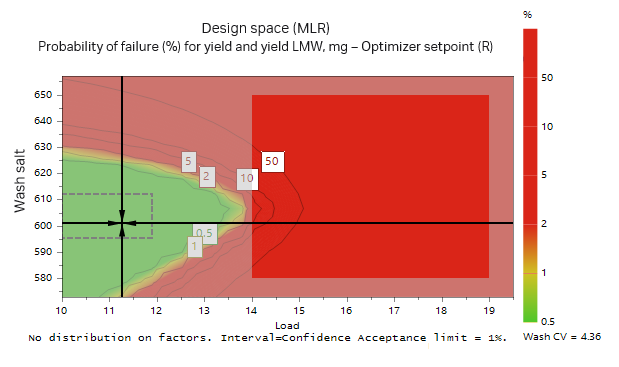
然后进行蒙特卡罗模拟,由此确定了收率和纯度的限值。其中重组蛋白的收率 > 95%,LMW 杂质 < 6%。根据蒙特卡罗模拟的结果,满足 1% 失败风险要求的最佳条件是蛋白上样量为 11.3 g/L 填料,而洗涤液的盐浓度为在 4.36 CV 下 600 mM(图 11)。根据蒙特卡罗模拟的结果,盐浓度对纯度和收率的影响列于表中。4.从图 11 中绿色区域也可以看出盐浓度的影响,尽管上样量和洗涤液的盐浓度有所变化,但仍在可接受的范围内。
表 3. 实验设计 (DoE) 的层析条件
| 实验编号 | 实验名称 | 运行顺序 | 上样量 (g/L) | 洗涤液盐浓度 (mM) | 洗涤液体积 (CV) |
| 1 | N1 | 1 | 14 | 580 | 4 |
| 2 | N2 | 9 | 19 | 580 | 4 |
| 3 | N3 | 6 | 14 | 650 | 4 |
| 4 | N4 | 7 | 19 | 650 | 4 |
| 5 | N5 | 11 | 14 | 580 | 10 |
| 6 | N6 | 10 | 19 | 580 | 10 |
| 7 | N7 | 8 | 14 | 650 | 10 |
| 8 | N8 | 2 | 19 | 650 | 10 |
| 9 | N9 | 13 | 13.5 | 615 | 7 |
| 10 | N10 | 14 | 19.5 | 615 | 7 |
| 11 | N11 | 4 | 16.5 | 573 | 7 |
| 12 | N12 | 5 | 16.5 |
657 | 7 |
| 13 | N13 | 12 | 16.5 |
615 | 3.4 |
| 14 | N14 | 16 | 16.5 |
615 | 10.6 |
| 15 | N15 | 3 | 16.5 |
615 | 7 |
| 16 | N16 | 15 | 16.5 |
615 | 7 |
| 17 | N17 | 17 | 16.5 |
615 | 7 |
| 18 | N18 | 18 | 10 | 590 | 4 |
| 19 | N19 | 19 | 10 | 590 | 10 |
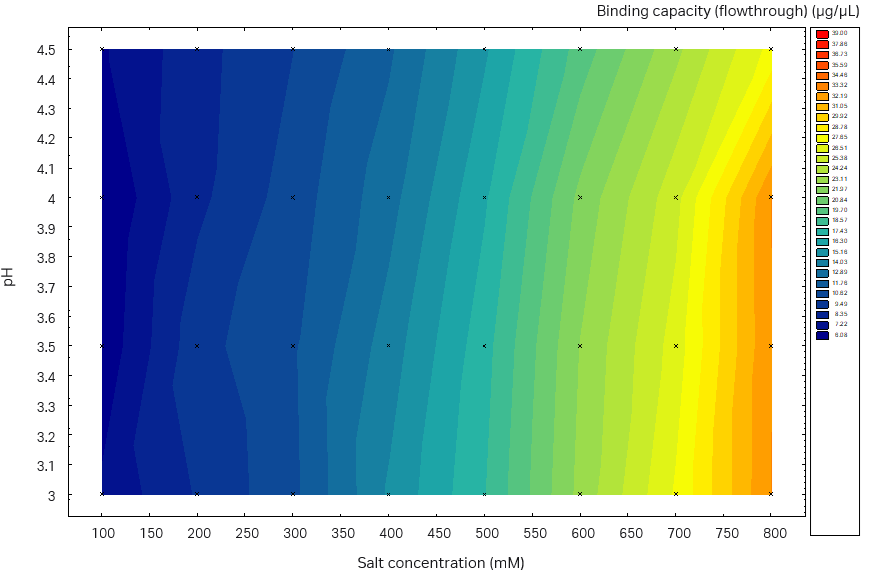
图 9. 重组蛋白纯度(低 LMW 收率 = 高蛋白纯度)与上样量、洗涤液盐浓度和洗涤液体积的关系的等值线图。
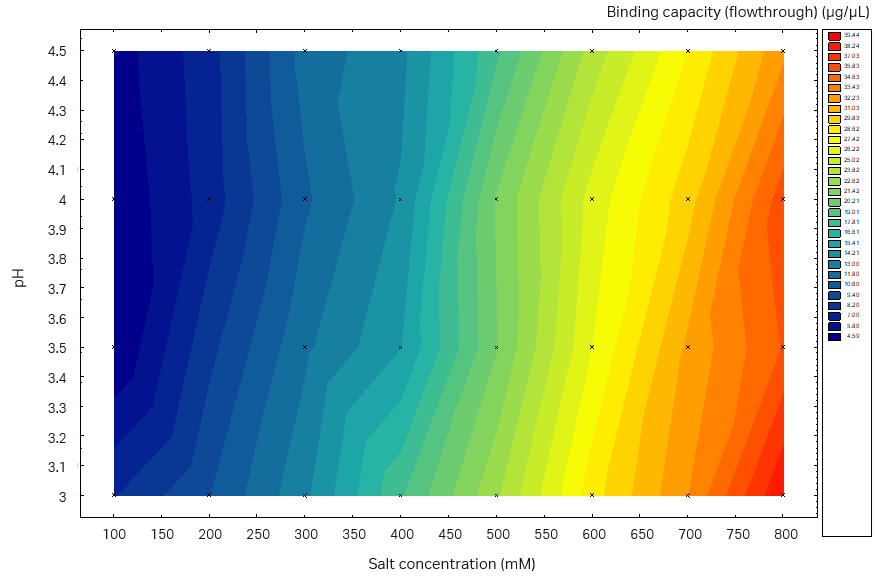
图 10. 重组蛋白收率与上样量、洗涤液盐浓度和洗涤液体积的关系的等值线图。
图 11. 实验设计 (DoE) 所确定模型的蒙特卡罗模拟。绿色区域表示使用 4.36 CV 洗涤液体积时失败概率小于 1% 的区域。可接受的结果为目的蛋白收率 > 95% 和 LMW 片段 < 6%。
表 4. 洗涤液盐浓度对收率和纯度的预期影响
| 上样量 (mg) | 洗涤液盐浓度 (nM) | 洗涤液体积 (CV) | 目的蛋白收率 (%) | 下限 (%) | 上限 (%) | LMW 收率 (mg) | 下限 (mg) | 上限 (mg) | 目的蛋白量 (mg) | 残留 LMW |
| 11.3 | 600 | 4.36 | 96.5 | 91.8 | 101.0 | 0.6955 | 0.6287 | 0.7622 | 10.90 | 6.00 |
| 11.3 | 590 | 4.36 | 94.4 | 89.7 | 99.1 | 0.6530 | 0.5809 | 0.7251 | 10.67 | 5.77 |
| 11.3 | 610 | 4.36 | 95.8 | 93.9 | 103.1 | 0.7379 | 0.6672 | 0.8087 | 10.13 | 6.22 |
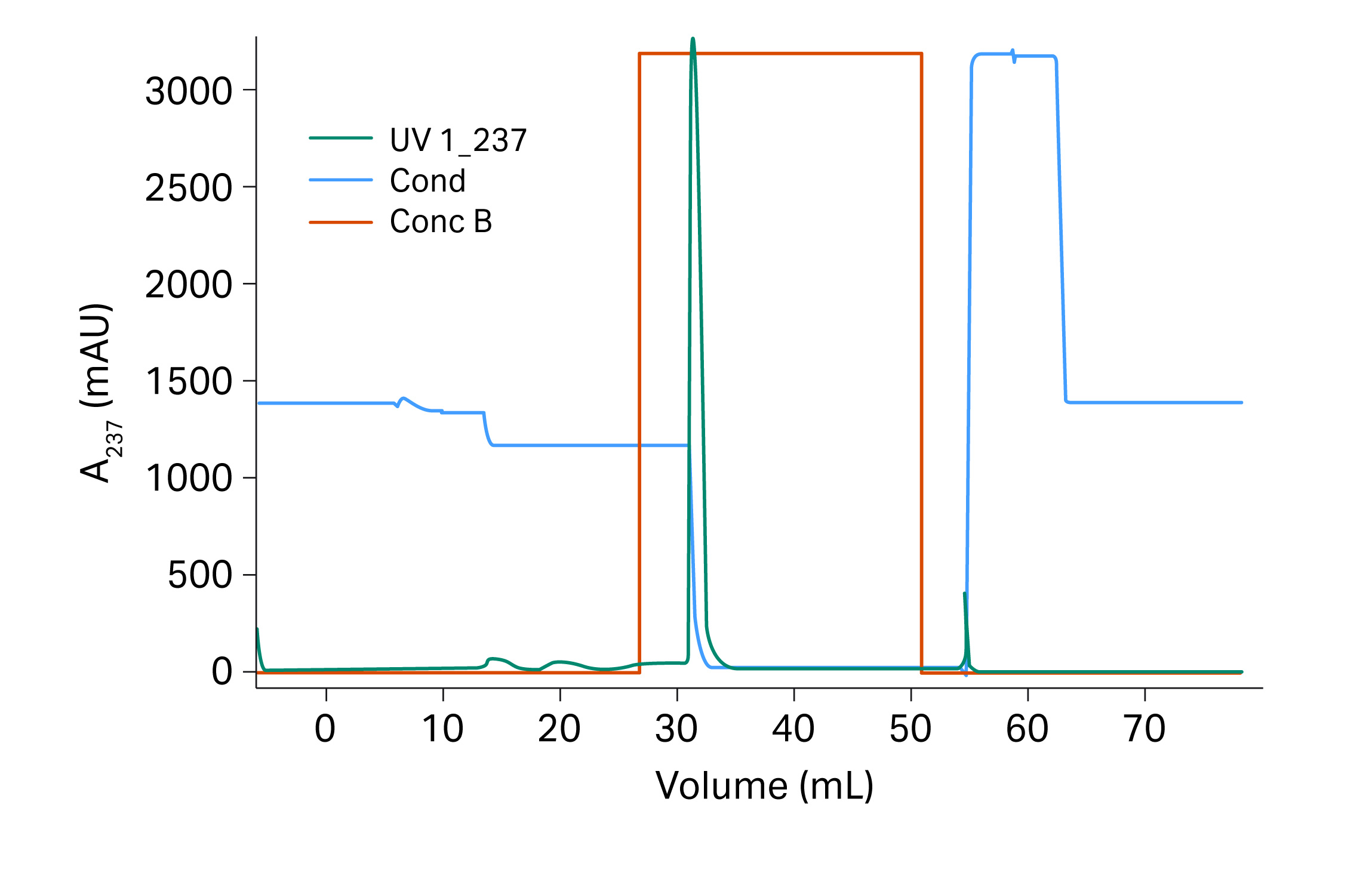
验证运行的条件采用蒙特卡罗模拟提供的最佳条件(图 12)。在一个 20 cm 的 Tricorn™ 5/200 层析柱中进行(之前实验的柱床高度为 10 cm)验证运行,结果应接近蒙托卡罗模拟的结果。
层析柱:Tricorn™ 5/200
样本:重组蛋白 (2.0 mg/mL)
上样量: 11.3 mg/mL
平衡缓冲液和样品缓冲液:100 mM 醋酸盐,800 mM 硫酸钠,pH 值 3.0
洗涤液: 100 mM 醋酸盐,600 mM 硫酸钠,pH 值 5.5,0.25 mL/min,4.36 CV
洗脱缓冲液:100 mM 醋酸盐,pH 值 5.5,5 CV
CIP:1 M NaOH,0.25 mL/min,2 CV
再平衡:平衡缓冲液,0.5 mL/min,5 CV
系统:ÄKTA pure™ 25
检测波长:237 nm
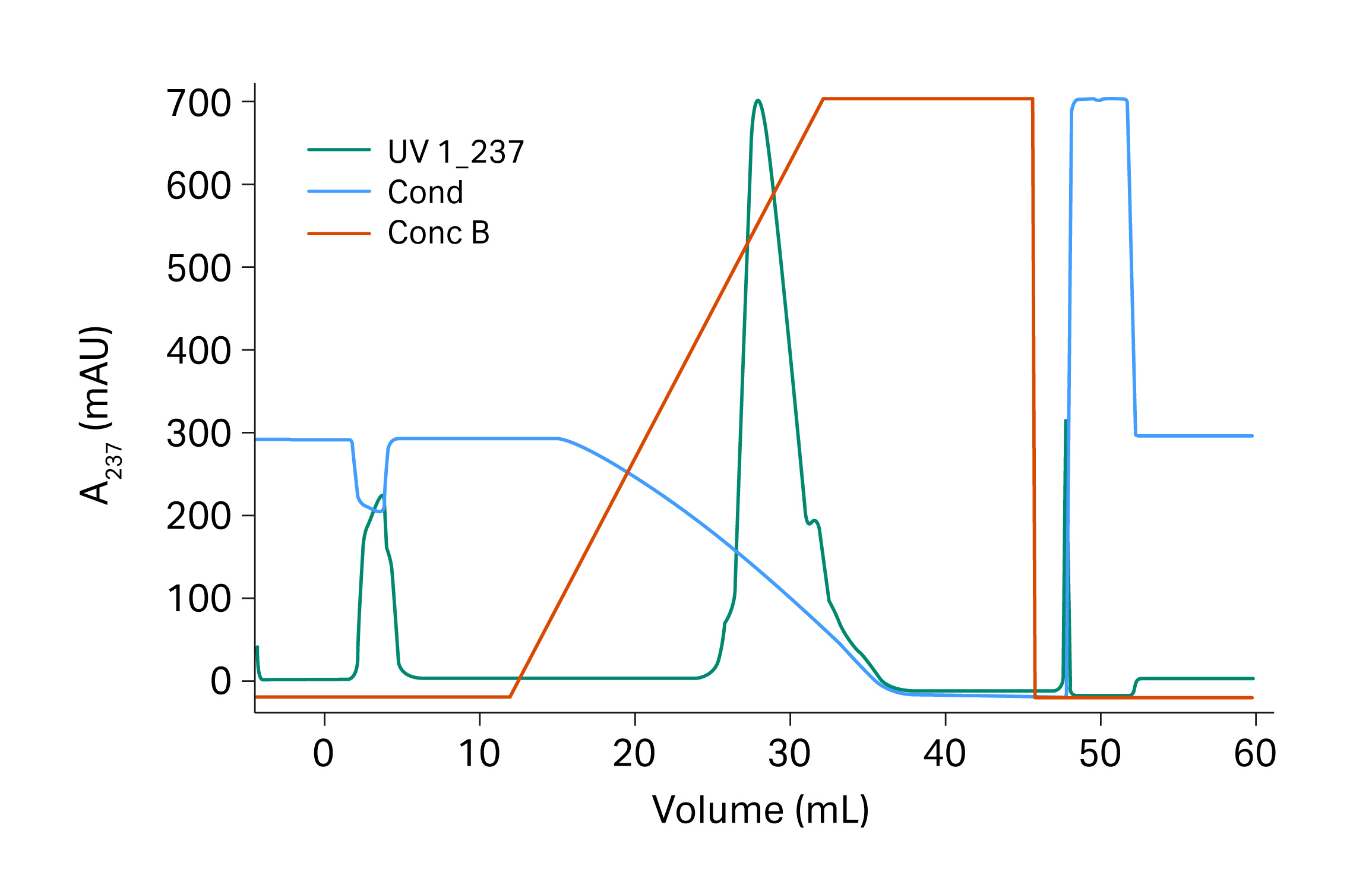
图 12. 使用 Capto™ Butyl ImpRes 填料进行重组蛋白的验证运行。
结果
验证运行的单体收率为 98%,洗脱液中的片段含量为 6.0%。与含有 14.9% 片段的起始样品相比,杂质最高减少了 2.5 倍。验证结果也列在表 5 中,可以看出结果与蒙特卡洛模拟的预期结果非常吻合。
表 5. 与验证实验结果相比的预期结果
| 蒙特卡罗模拟的预期结果 | 实验结果 | |
| 收率 (%) | 96(91 至 101) | 98 |
| 残留 LMW 杂质 (%) | 6.0 | 6.0 |
本文介绍了使用 HIC 填料优化重组蛋白中间纯化步骤条件的工作流程。目标是实现目的蛋白的高收率并显著提高纯度,在我们本次的研究中即为减少 LMW 片段的含量。
本次研究利用孔板研究分析了三种填料的结合载量,它们分别是 Capto™ Butyl ImpRes、Capto™ Phenyl ImpRes 和 Capto™ Phenyl (High Sub)。由于 Capto™ Butyl ImpRes 结合载量高,并在确定的洗脱条件下具有获得良好收率的潜力,因而选择它进行层析柱研究。
采用实验设计 (DoE) 优化洗涤步骤及其他层析参数,以提高重组蛋白的纯度,并使用 Tricorn™ 5/100 层析柱进行验证运行,以确认实验设计 (DoE) 的结果。然后进行蒙特卡罗模拟以确定达到预期收率和纯度的稳健条件。在确定的条件下进行了验证运行并达到了预期结果,即片段含量由 15% 降为 6%,单体收率为 98%。
通过分析结果我们发现,增加精纯步骤对于进一步减少杂质(包括此次未研究的其他杂质在内)是非常有利的。精纯步骤的选择应具有正交特点,具体到本研究可以使用阴离子交换层析法。
此外,还有一种工具可以节省时间和创建更稳健的工艺,那就是机理建模。机理建模利用计算机模拟来减少实验次数。
CY27574-27Oct22-AN
TR29795027
相关链接