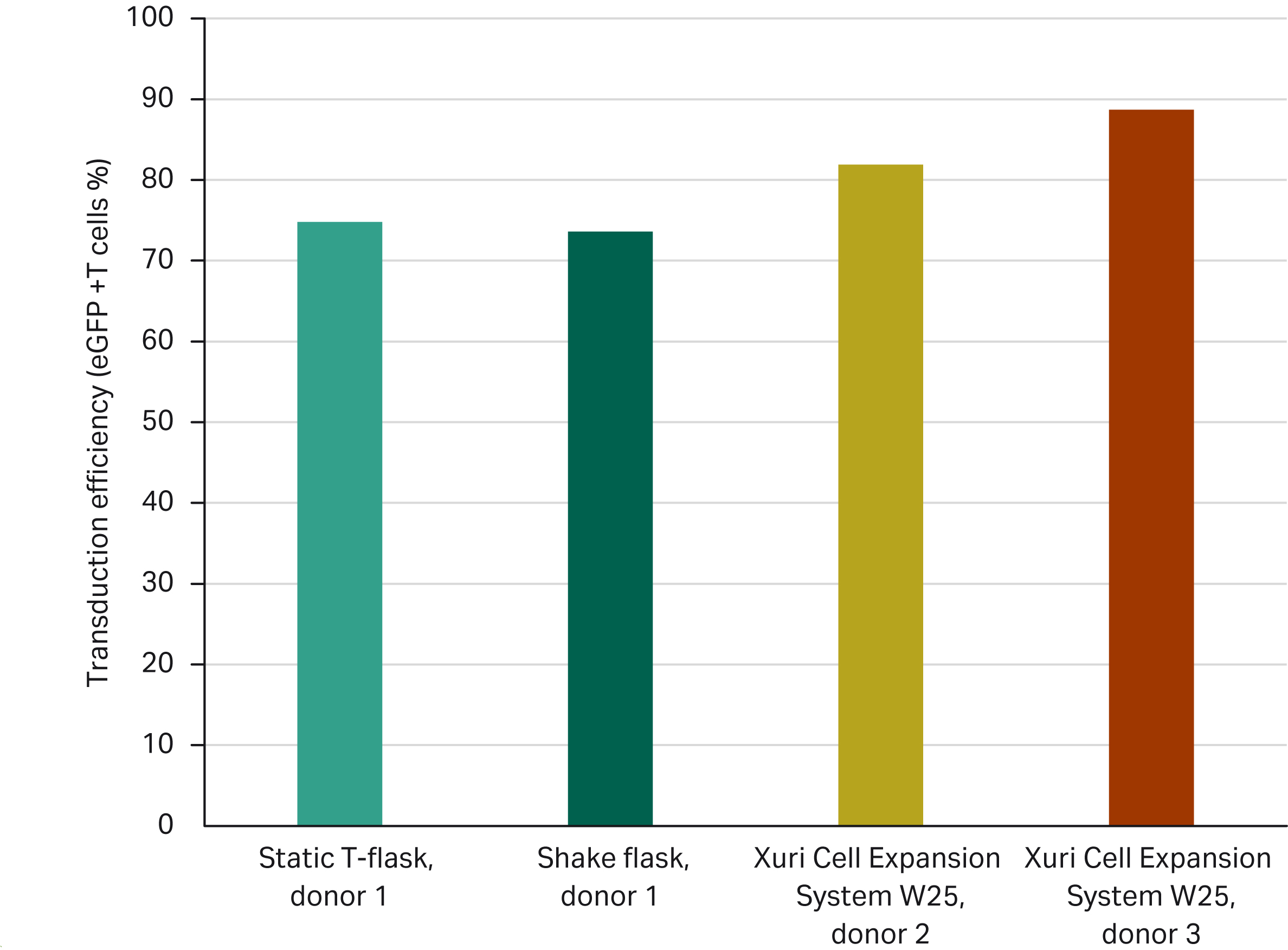2023 年 8 月更新
研究概述:通过自动离心转导程序,利用慢病毒转导,实现基因转移
嵌合抗原受体 (CAR) T 细胞疗法的封闭式、自动化生产需求不断增加。CAR T 工作流程依靠慢病毒转导进行体外基因转移,以达到治疗效果。为了简化此步骤,同时保持工艺开发的灵活性,我们引入了使用现有的 Sepax C-Pro 技术的独立应用软件。
SpinOculation C-Pro 应用软件可以自动完成慢病毒载体 (LVV) 转导,采用封闭式处理系统和一次性套件;重要的是无需使用转导增强剂。我们提供不同的应用案例,结合专门的上游工艺和病毒来源,介绍如何利用 SpinOculation C Pro 软件参数灵活地进行工艺优化,提高 LVV 转导效率。
简介:CAR T 细胞疗法生产工作流程中对封闭式自动化慢病毒转导步骤的需求
随着 T 细胞免疫疗法的开发和使用,临床和生物制药领域的癌症治疗手段出现了新的变化。随着 Novartis (Kymriah™) 和 Gilead/Kite (Yescarta™) 的自体 CAR T 细胞疗法的获批,对细胞和基因治疗生产的自动化、封闭式解决方案的需求不断增长。这些工艺要想实现工业化,需要加强风险管理并提高可放大性和可重现性。
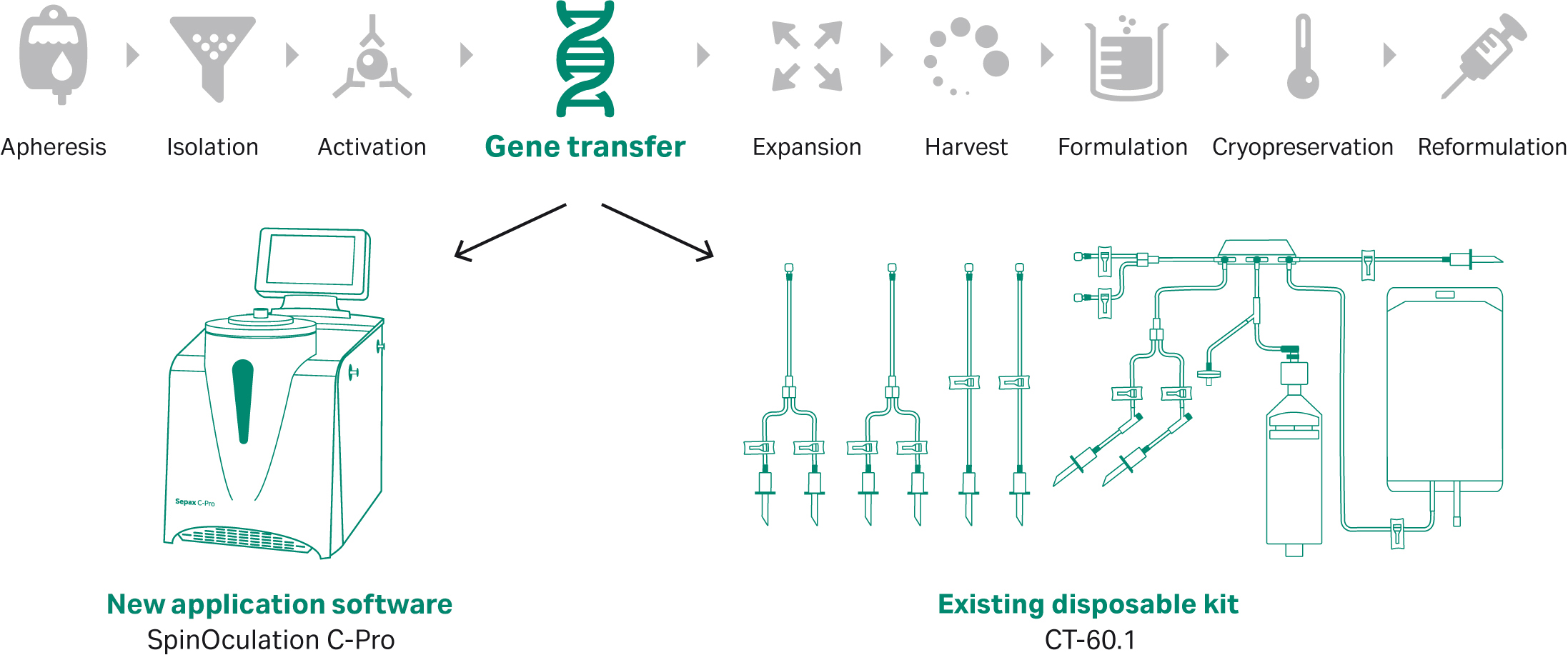
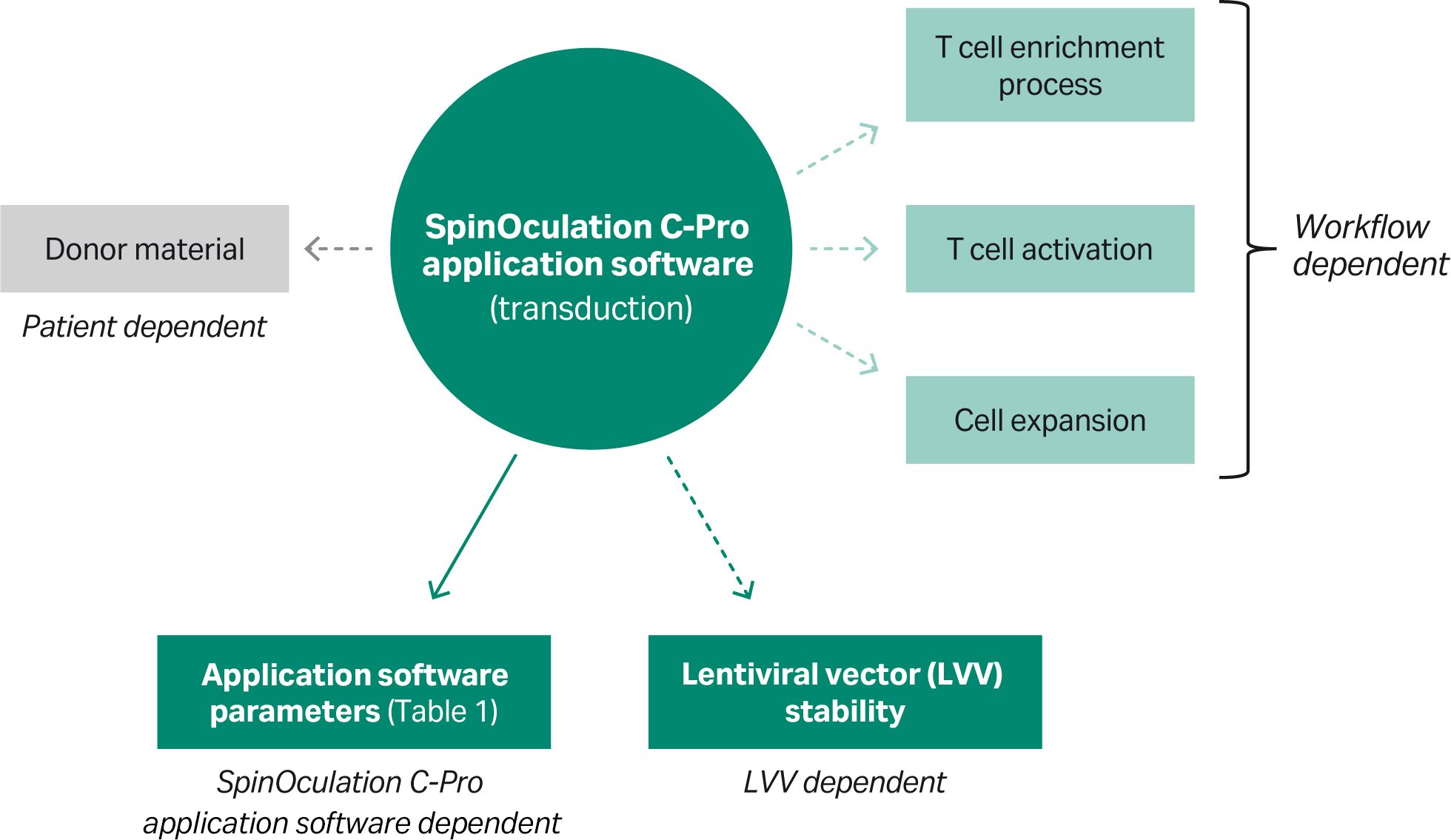
尽管 CAR T 细胞疗法生产的大部分工作流程步骤都可以使用自动化设备完成,但其他步骤(例如慢病毒转导介导的基因转移)的方法和技术仍需改进。SpinOculation C-Pro 应用软件与 Sepax C-Pro 仪器和 CT-60.1 一次性套件结合使用,该软件是新开发的独立解决方案,旨在让慢病毒转导得到简化和自动化,并可以保持工艺开发的灵活性(图 1)。
SpinOculation C-Pro 应用软件允许用户在转导步骤中调整输入细胞体积,以达到特定的细胞密度。此外,该应用程序还提供封闭式离心系统,帮助完成基因转移,无需使用物理化学性的转导增强剂。最终输出体积可根据客户的具体需求进行调整。
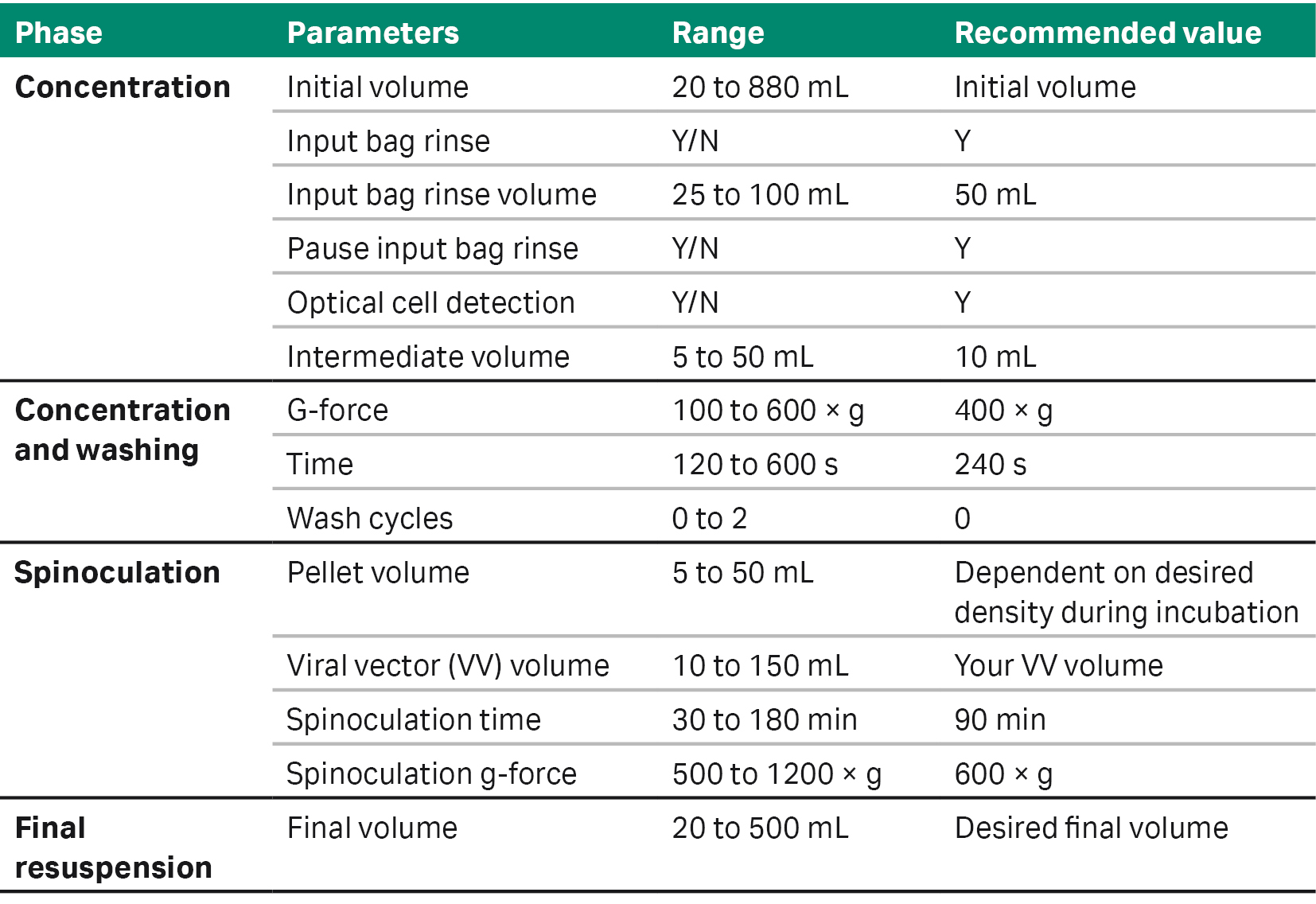
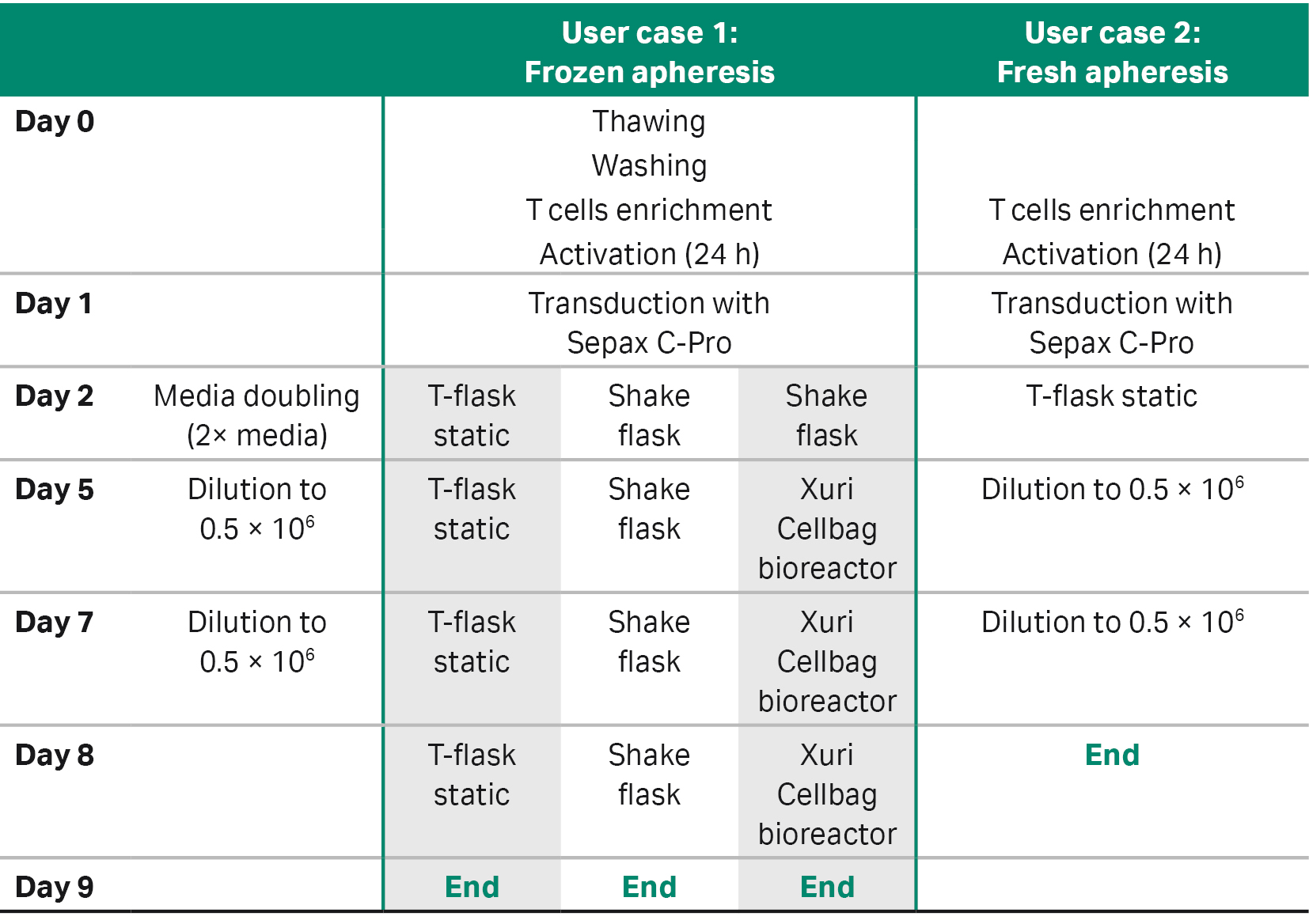
表 1 概括了该应用软件的可调整参数及参数范围,用户可以根据自己的工艺进行自定义设置。下面我们通过两个应用案例介绍在不同的 CAR T 细胞工作流程中进行慢病毒载体转导时,如何使用 SpinOculation C-Pro 应用软件(图 2)。
图 1. SpinOculation C-Pro 应用软件与 Sepax C-Pro 仪器和 CT-60.1 一次性套件结合使用,提供灵活、自动化、封闭式的 T 细胞慢病毒转导解决方案。该应用程序可以集成到包含基因转移单元操作的 CAR T 工作流程中。
表格 1. SpinOculation C-Pro 应用软件的参数
材料和方法:使用冷冻、新鲜的单采血液样本进行自动和手动基因转移
应用案例 1:冷冻单采血液
第一个应用案例使用从三名健康供体采集的冷冻单采血液样本。使用自动干式解冻设备*解冻冷冻单采血液样本。然后,在使用 EasySep™ Release 人 CD3 阳选试剂盒 (STEMCELL Technologies) 开始手动进行 T 细胞富集之前,使用封闭式细胞处理系统†清洗制品。然后使用 ImmunoCult™ 人 CD3/CD28/CD2 T 细胞活化剂 (STEMCELL Technologies) 在细胞培养瓶 (Thermo Fisher Scientific) 中手动活化分离的 T 细胞,密度为 1 × 106 个细胞/mL,在恒温恒湿培养箱中培养 24 小时(37°C、5% CO2)。然后用 LVV– 增强型绿色荧光蛋白 (eGFP) (Tailored Genes) 转导活化的 T 细胞,感染复数 (MOI) 为 2.5。将活化的 T 细胞分成两组,一组采用传统的培养容器(即经过组织培养物处理的 Nunc™ 培养瓶),一组采用 Sepax C-Pro 仪器的 SpinOculation C-Pro,并比较两种方法的转导效果。
* 我们使用专有设备进行上游既上游和下游工艺中使用 VIA Thaw™ 仪器。
†本研究中使用了封闭式的细胞处理设备。但是,建议在生产时使用与此等效的 Sepax™ C-Pro 仪器。
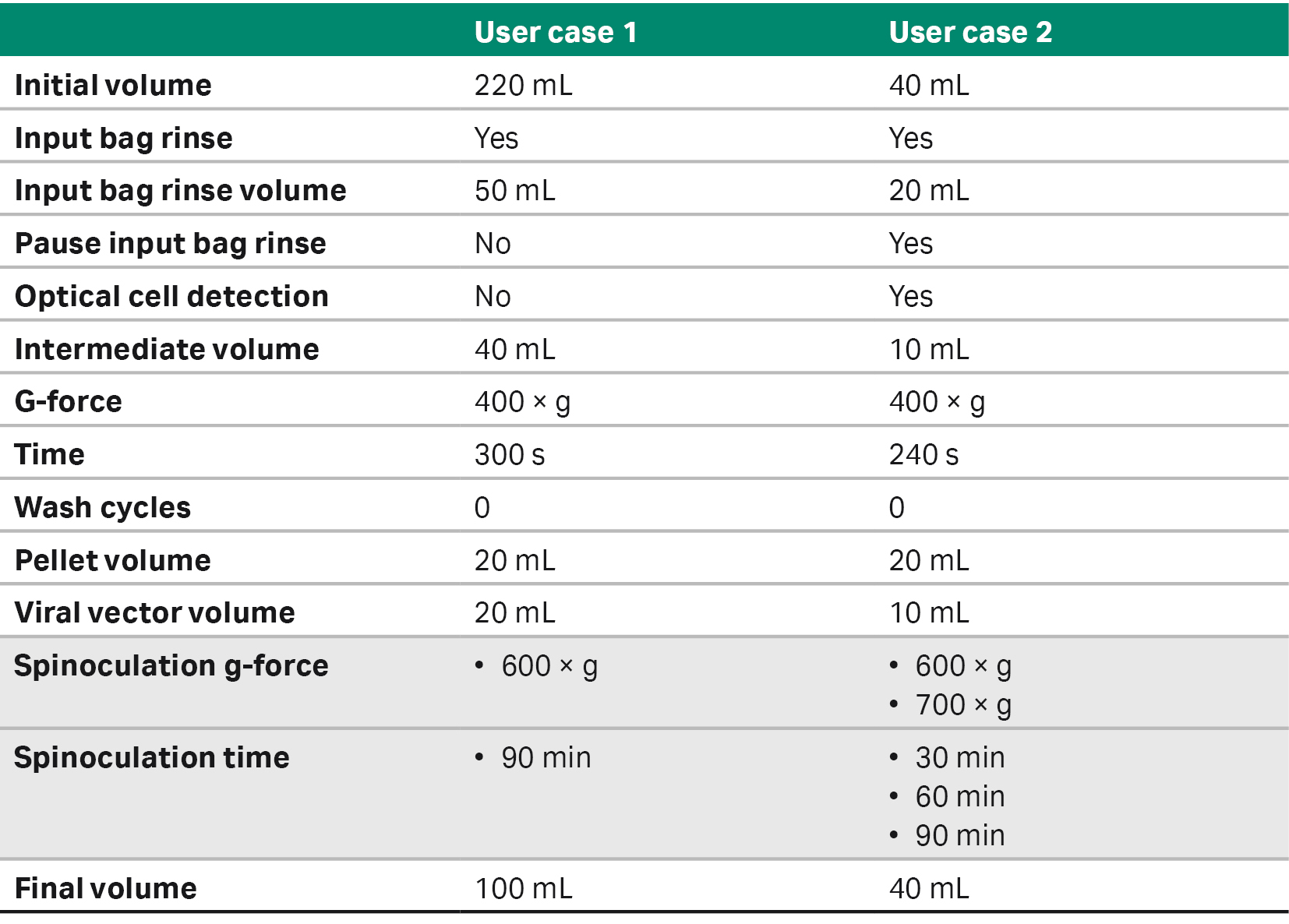
传统方法包括手动将病毒添加到开口培养瓶中,转导后 16 至 20 小时添加新鲜培养基继续培养。使用 SpinOculation C-Pro 应用软件通过封闭式自动化的方法转导细胞,将病毒装在放置于冰上的无菌注射器 (BD Biosciences) 中。将带有焊接管线的含细胞的袋和含病毒的注射器以无菌方式焊接到 CT-60.1 Sepax C-Pro 细胞处理套件上,并在 Sepax C-Pro 仪器上运行(表 2、3)。
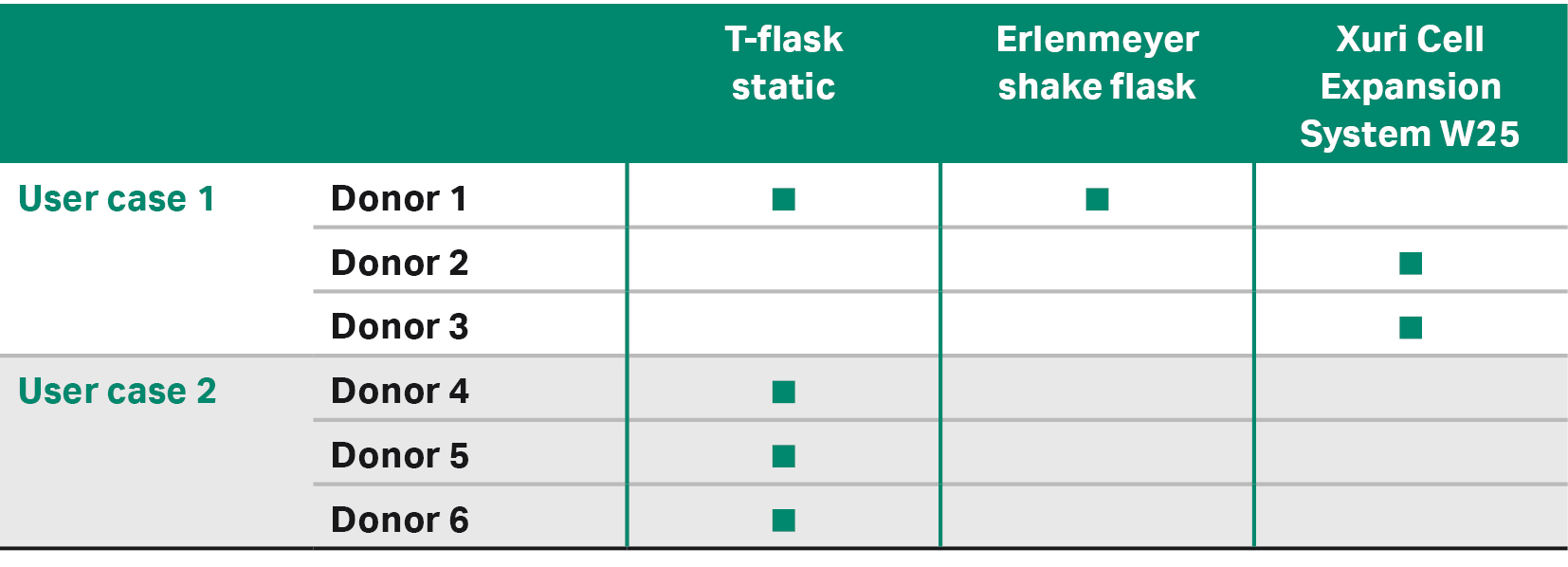
应用案例 1 比较了转导细胞的三种不同的下游扩增方法:其中两种为小规模扩增,一种为大规模扩增(表 3、4)。
第一种小规模扩增方法类似于上述的手动培养,扩增方法类似于使用传统、静态的经组织培养处理的 Nunc 培养瓶扩增经离心转导的细胞。第二种小规模扩增方法使用密闭容器系统和 Erlenmeyer 摇瓶,接种密度为 1 × 106 个细胞/mL,并置于 MaxQ™ CO2 Plus 摇床以 90 rpm 进行动态培养,但仍需要放置在恒温恒湿培养箱中(37°C、5% CO2)。这些培养物在转导后继续培养 3 天,然后进行计数,并在第 5 天和第 7 天用新鲜培养基稀释至 5 × 105 个细胞/mL。细胞一直扩增至第 9 天(总共 8 天)。
第三种方法是大规模扩增法。前 4 天使用 Erlenmeyer 摇瓶系统对离心转导细胞进行扩增,然后使用 2 L Xuri Cellbag™进一步扩增™生物反应器 (Cytiva)。将 Cellbag 置于 5% CO2 的 Xuri 细胞扩增系统 W25 (Cytiva) 上,并无菌焊接装有培养基的储液器。培养基的配方与小规模培养时使用的配方相同。将初始体积 200 mL 的培养基添加到生物反应器中,放置一夜以使其平衡。设置系统参数:温度为 37°C,气体流速为 0.05 L/min,摇床转速为 10 rpm,角度为 6°。在 Erlenmeyer 摇瓶中培养共 4 天后,将培养物转移并接种到生物反应器中,并加入培养基,使生物反应器中的培养物总体积达到 500 mL。开始培养后,以 1 L/d 的流速将新鲜培养基添加到生物反应器中并过夜培养,使总体积达到 1 L。从第 5 天起,按每天 1 L 培养基的流速连续灌注培养基,以控制乳酸盐、铵和葡萄糖水平。
添加培养基后 48 小时,使用 CytoFLEX™ 流式细胞仪 (Beckman Coulter) 测量转导效率。向 Xuri T 细胞扩增培养基 (Cytiva) 中补充 5% 热灭活的人 AB 血清 (Gemini) 和 350 IU/mL Xuri IL-2 生长因子 (Cytiva),以制备细胞培养基,然后使用该细胞培养基完成所有后续步骤。每日取样,进行细胞数、活力和生化分析(乳酸盐、铵、葡萄糖和 pH 值)。
在扩增阶段结束时(第 9 天),使用 VIA Freeze™仪器 (Cytiva) 冷冻保存 CAR T 细胞。在扩增阶段结束时(第 9 天)进行流式细胞仪分析,以评估转导效率。对于大规模实验,在细胞扩增后,使用 Sefia™S-2000 细胞处理仪、FlexCell 应用软件和 CT-800.1 细胞处理套件 (Cytiva) 收获 T 细胞。简言之,以 75 mL/min 的流速将 1 × 1010 个 T 细胞的体积减少到 50 mL。使用补充有 10% 人血清白蛋白 (Gemini) 的 PLASMA-LYTE A (Baxter) 进行两轮洗涤。以 400 ×g 的离心力洗涤 5 分钟。然后,以 1 × 108 个细胞/mL 的密度在含 50% CryoStor™ CS10 (BioLife Solutions) 和 5% 人血清白蛋白的 PLASMA-LYTE A 中重悬 T 细胞,并分装在三个 CryoMACS™ 50 冻存袋 (Miltenyi Biotec) 中。将这三个冻存袋装入 VIA Freeze Quad™降温仪 (Cytiva) 内(降温速率为 -1°C/min),降温至 -100°C。冷冻后,将所有细胞转移至液氮储存器中。
应用案例 2:新鲜单采血液
在第二个应用案例中,使用从三名单独的健康供体采集的新鲜单采血液样本。第一步包括使用 EasySep Release 人 CD3 阳选试剂盒 (STEMCELL Technologies) 进行手动 T 细胞富集。然后使用 ImmunoCult 人 CD3/CD28/CD2 T 细胞活化剂 (STEMCELL Technologies) 在方瓶 (Thermo Fisher Scientific) 中手动活化分离的 T 细胞,密度为 1 × 106 个细胞/mL,在恒温恒湿培养箱中培养 24 小时(37°C、5% CO2)。然后用 LVV–eGFP (Jiman Biotech) 转导活化的 T 细胞,MOI 为 5。活化的部分 T 细胞在经组织培养处理的 Nunc 方瓶中转导,转导后 24 小时添加新鲜培养基,使培养基体积加倍。使用 SpinOculation C-Pro 应用软件转导其余部分活化的 T 细胞。将含细胞和病毒载体的袋焊接到 CT-60.1 Sepax C-Pro 细胞处理套件上,并在 Sepax C-Pro 仪器上运行(表 2、3)。添加培养基后 48 小时,使用流式细胞仪 (BD Canto) 测量转导效率。向 RPMI 1640 (Gibco) 中补充 10% 胎牛血清和 250 IU/mL Xuri IL-2 生长因子 (Cytiva),以制备细胞培养基,然后使用该细胞培养基完成所有后续步骤(表 4)。
应用案例 2 仅使用了一种静态扩增方法(表 3)。将转导细胞接种到经组织培养处理的 Nunc 培养瓶中,接种密度为 1 × 106 个细胞/mL。将细胞在培养箱中培养(37°C、5% CO2)3 天,然后计数,并稀释至 5 × 105 个细胞/mL。将细胞再培养三天,然后(第 8 天,在扩增阶段结束时)通过流式细胞仪进行表型分析,以评估转导效率。
表 2. 每个应用案例的 SpinOculation C-Pro 应用软件参数
表 3. 每个供体和应用案例使用的扩增方法
表 4. 工艺工作流程的详细信息
结果:通过离心转导进行 CAR T 细胞慢病毒转导的自动与手动方法比较
通过自动化程序与相应的手动控制获得的转导效率比较
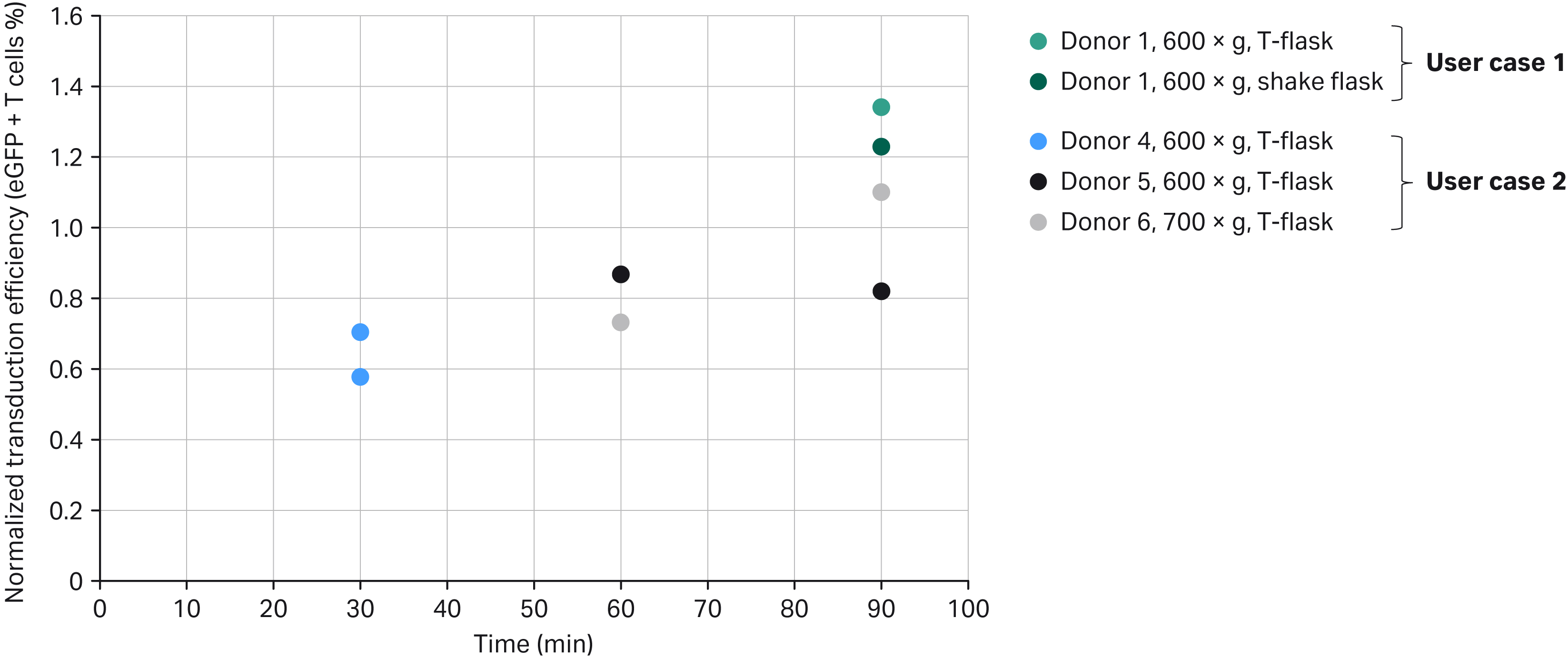
图 3. 在扩增阶段结束时,SpinOculation C-Pro 应用软件与手动控制性能的归一化转导效率比较。请注意,该图中未显示供体 2 和 3,因为他们仅使用 Xuri 细胞扩增系统 W25 进行转导,没有设置方瓶对照组(另请参见表 3 和图 5)。
将不同的离心转导过程与其各自的单独供体静态对照组进行比较,对四个供体(一个来自应用案例 1,三个来自应用案例 2)的转导效率进行归一化处理,后者使用开口培养瓶(应用案例 2 和两个应用案例 1 数据点中的一个)或在翻转的 Erlenmeyer 摇瓶中(第二个应用案例,一个数据点)进行手动处理。供体 1 材料使用应用案例 1 工作流程进行处理,时间为 9 天(24 小时活化,8 天细胞扩增)。供体 4、5 和 6 材料使用应用案例 2 工作流程进行处理,时间为 8 天(24 小时活化,7 天细胞扩增)。
每隔两天进行转导效率评估。图 3 表示扩增阶段结束时(应用案例 1 为第 9 天,应用案例 2 为第 8 天)获得的转导效率。将 Sepax C-Pro 中的离心转导时间从 30 分钟增至 90 分钟,我们观察到扩增阶段结束时转导效率趋于增加,但不同供体存在一定的差异。
观察到转导效率的范围非常大,在 31% 至 75% 之间。转导效率可能与多种因素有关,例如病毒构建体来源、使用的工作流程(应用案例 1 与应用案例 2)、所选方案参数的组合以及供体材料。
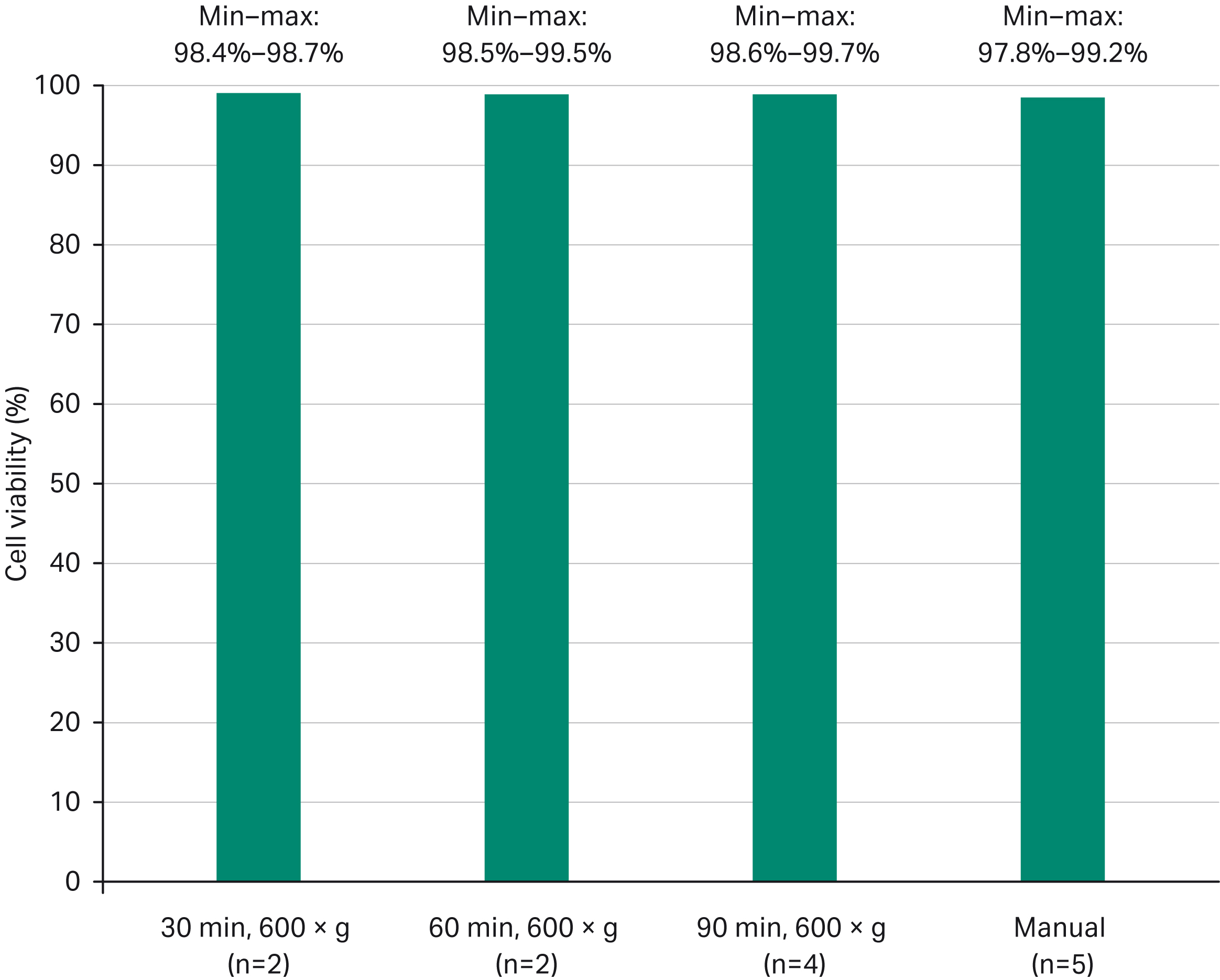
图 4. 扩增阶段结束时通过手动与自动工艺获得的平均细胞活力 (%) 比较结果。
尽管用 LVV 细胞接种使用的离心力较高 (700 × g)(90 分钟),但所有案例中后续扩增阶段的细胞活力都保持在 97% 以上,与手动过程相当。
应用案例 1 和不同扩增方法获得的转导效率比较结果
图 5 通过三种不同的扩增方法进行细胞扩增 8 天后,对其获得的转导效率进行了比较。这四个实验是使用应用案例 1 的材料和方法完成的。手动方法(方瓶和摇瓶)的输入制品来自同一供体。而使用自动化 Xuri 细胞扩增系统 W25 完成的两个实验的输入制品来自两个不同的供体。
图 5. 在 Sepax C-pro 中以 600 ×g 的离心力离心处理 90 分钟进行离心转导,然后使用手动(方瓶、摇瓶)或自动化(Xuri 细胞扩增系统 W25)过程扩增 8 天后获得的转导效率。
当使用应用案例 1 中的方法和相应的 LVV MOI 为 5 时,在所有实验条件下(包括不同的生物供体和扩增方法),扩增阶段结束时的转导效率均高于 70%。
我们观察到,当在不同的扩增方法(方瓶与摇瓶)中使用来自同一供体(供体 1)的输入材料时,扩增结束时获得的转导效率相当(分别为 75% 和 74%);当使用相同的扩增方法(Xuri 细胞扩增系统 W25)但供体材料(供体 2 和 3)不同时,在扩增结束时获得的转导效率在 82% 至 89% 之间(图 5)。
结论:在 CAR T 细胞疗法生产中采用封闭式自动化 LVV 转导
从这些应用案例可以看出,SpinOculation C-Pro 应用软件提供了封闭式、自动化 LVV 转导步骤解决方案,获得的转导效率可与手动、开放式工艺相当。该开源软件参数允许用户改变多个参数的设置,为工艺开发和优化提供了多种灵活的选项(表 1)。
需要特别注意的是,许多因素会影响所达到的性能(图 3、4)。然而,值得注意的是,实验显示转导效率高度依赖于 LVV 来源和所使用的 MOI。此外,T 细胞的上游制备(富集阶段)以及用于扩增转导 T 细胞的方法和试剂可能会影响转导水平(图 5、6)。转导下游的单元操作和处理步骤,例如 T 细胞扩增方法和培养容器,也会影响最终制品的转导效率(图 5)。
SpinOculation C-Pro 应用软件满足了 CAR-T 细胞疗法对封闭式自动化工作流程解决方案的需求,有助于实现工艺标准化、尽可能降低风险并减少可变性。
图 6. 复杂模型的简单解决方案。可能影响转导性能的因素概述。虽然大多数因素可以标准化,但供体材料可能存在差异。
* 我们使用专有设备进行上游解冻。另一种方法是在上游和下游工艺中使用 VIA Thaw™ 仪器。
†本研究中使用了封闭式的细胞处理设备。但是,建议在生产时使用与此等效的 Sepax C-Pro 仪器。