文章灵感源于 Tapas 和 TECH Talks 数字活动,其中包含从客户合作中获得的见解。
您可以通过利用早期关于工艺开发、质量保证和质量控制策略的决策,为自己建立一套成功的 cGMP 制造工作流程。本文将讨论如何以生产工作流程的思维方式进行工艺开发,从而顺利过渡到 cGMP 制造。
了解稳健的设计
定向工艺开发意味着您需要专注于确保制造工艺的稳健性。要了解稳健的设计,您必须了解开始对后续的一切产生重大影响的工艺开发阶段。从合规性的角度看,我们有句俗话“工艺即产品”。因此,早期的关键决策将影响您实现目标的方式。
关键问题:
- 您会使用手动还是功能上封闭的工艺?
- 您会选择一次性使用吗?
- 您是否使用专门的设备系列?
这里有几个因素,其中三大因素是:
- 您能以多快的速度启动项目?
- 这个项目的成本是多少?
- 这些选择的效果如何?
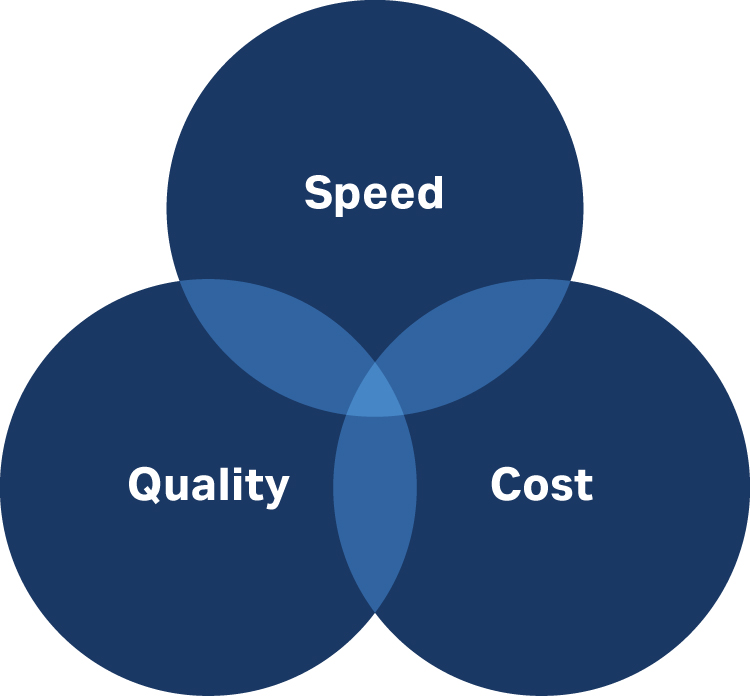
理想情况是实现高速、低成本和高质量(图 1)。通常,您只能从三者中选择其二。
图 1:在开发细胞治疗工艺时,请考虑如何平衡质量、速度和成本。
但最重要的是,只求质量。如果您能够一次性做好,则可以避免第二次或第三次才做好所消耗的时间和成本。
管理差异
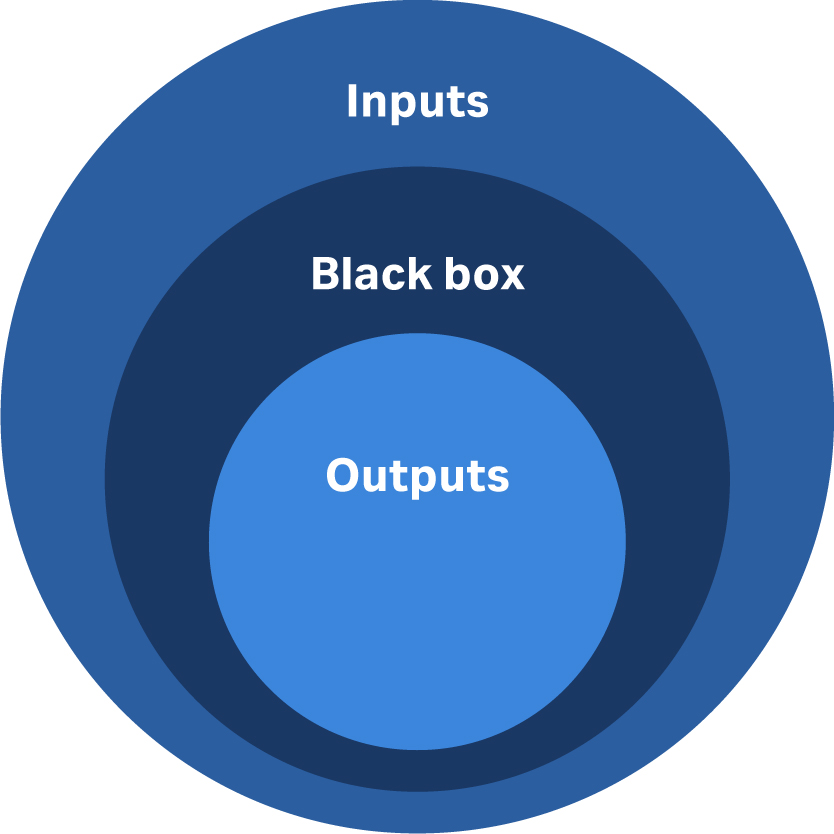
稳健的设计就在于管理差异。从了解差异的来源开始。变化的基本类别如图 2 所示。圆圈大小代表其相对贡献。
图 2:细胞或基因治疗工艺中差异根源的主要类别。
最大的影响来自投入方面的差异,包括原材料、劳动力、设备系列的选择和分析。
下一个最大的影响是运行过程本身的情况,有时称为“黑箱”。这种差异取决于设施和设备的运行情况,而这又取决于辅助支持、劳动力以及劳动力的经验或训练有素的程度。最后,产出方面的差异通常最小。然而,在 CCRM,我们发现制造的产品数量可能存在显着差异。典型的制造商依赖于将输出与理论产量进行比较的绩效衡量。但是对于细胞和基因治疗,计算理论产量非常具有挑战性。此外,运输方面可能存在差异,特别是冷链方面。
工艺能力
这是对系统可处理差异水平的数学衡量,但仍能提供高质量的输出。这确实是稳健性的衡量标准。差异不仅存在于烧瓶或生物反应器的内部工艺中,而且存在于所有涉及制造的工艺中。这些工艺包括性能衡量,即在工艺差异描述中使用分析方法来监控质量和工艺性能。
要理解稳健设计,您可以想象一个相对可控但仍有自然变化的工艺。作为制造科学家,我们将致力于改进工艺以进一步减少这种自然差异。这些努力被认为是六西格玛的应用。对于每个流程,都会使用多种分析方法来帮助监控进展。每一种方法都有其自身的自然差异。但是,理想情况下,您希望分析方法的差异幅度远小于工艺中的自然差异,以便以显著的分辨力检测制造工艺中的变化。
进行关键工艺开发的一个风险是,如果有人通过革命性的变革来推进制造工艺,我们可能会看到一种转变,即分析中的差异可能高于工艺本身。在这种情况下,您将失去能够监控工艺本身的分辨力。然后,下一个挑战是推进分析,因为如果在分析中没有这种分辨力,则很可能无法检测到工艺差异。纵观整个产品开发生命周期,CCRM 处于工艺开发的最佳位置。我们的最终目标是支持第一阶段和第二阶段临床试验的制造。
在细胞和基因治疗领域,技术策略通常变化很大,因为制造流程仍然需要人工操作。然而,制造项目的视角不同于研发或工艺开发实验室中使用的视角。没有必要为单个单元操作寻找最佳性能。相反,整体性能和性能稳健性是关键。
提示:在 99% 的运行时间内达到 70% 效率的工艺优于在 70% 的运行时间内达到 99% 效率的工艺。因此,最好返回某一工艺以进行更多工艺开发工作,以进行效率优化。这应该尽早完成,以利用较低的整体工艺转换成本。
控制策略
提示:在进入第二阶段之前查看并关闭工艺系统。CCRM 的制造科学家以推进控制策略为目标来研究项目。表 1 列出了控制策略的六个要素,每个要素都有不同的进展路径。
表 1:理解稳健设计的控制策略
| 控制要素 | 描述 |
|---|---|
| 工艺控制 | 方案、SOP、工程批记录和 GMP 批记录 协议、开发的测试方法(TM)、合格的 TM 和经验证的 TM |
| 材料控制 |
所选材料 → 合格材料 → USP <1043> |
| 设备控制 |
所选设备→已安装设备→合格设备(IQ/OQ/PQ) |
| 战略决策 |
开放式与封闭式、生物反应器类型、纯化类型和选择策略、分析方法 |
| 人工控制 |
从一般到特殊的人员培训记录 |
| 设施控制 |
工艺开发空间、试验工厂和受控制造空间 |
工艺始于餐巾纸背面的一个想法。CCRM 可以使用该餐巾纸,将其发展为标准操作程序 (SOP),然后可以通过可行性研究进行更多的努力。在成功执行可行性之后,我们可以准备进入试验工厂,或直接进入制造区域,并根据工程批记录进行工程工作。然后,工程批记录可以将进度传达给完整的主批记录。分析方法是从一个非常相似的路径开始。
提示:从您的材料控制中选择材料,测试其可行性,并确保其在您开始工程运行之前合格。
提示:对于设备控制,选择正确的设备,使其安装到位,然后通过 IQ/OQ/PQ 活动进行资格认证。
应尽早做出战略决策:
- 您要使用开放系统还是封闭系统?
- 您将使用哪种类型的生物反应器系统?
- 您将使用哪种类型的纯化和收集策略?
- 您需要哪些分析方法来衡量性能?
对于员工控制,重要的是要了解在特定开发阶段支持制造实验室所需的培训,这些培训必须记录在案。设施控制通常是相当固定的。工艺开发工作将在工艺开发空间中完成。如果员工有权访问试验工厂,他们可能对工艺控制具有中级访问权限。如果员工在制造空间工作,则将实施完全访问控制。控制策略的决策必须适时进行,以便进入工艺开发的下一阶段。
当您在研发空间执行手动流程时,系统是可管理的,因为您可能一次只生产 1 剂。但是,当您进入第一阶段临床研究的生产阶段时,您可能会生产 3 到 5 剂,也许是 10 剂。对于第二阶段研究,您最多可以生产 50 剂。该策略更具挑战性,更重要的是,随着剂量的增加,成本也会更高。但重要的是尽早考虑这一点,从而您可以在商业市场上取得成功,实现每年生产数万剂的设想。
查看录制的会话,以了解在什么时间哪个控制级别是合适的并获得更多建议。